Fotosmog
Ozon ist eine dreiatomige Modifikation des Sauerstoffs und chemisch viel reaktiver als der viel häufiger vorkommende Disauerstoff. Ozon besitzt einen charakteristischen Geruch, den man z. B. gut in Copyshops wahrnehmen kann.
Es entsteht u. a. in der oberen Atmosphäre unter Einwirkung von UV-Strahlung aus Sauerstoffmolekülen und bildet die schützende Ozonschicht der Erde. Diese ist für uns wichtig, weil sie biologisch schädliche UV-Strahlung von der Erdoberfläche fernhält.
In Bodennähe ist die Ozonkonzentration dagegen normalerweise gering. Im Sommer verursachen Autoabgase jedoch eine verstärkte Bildung von Ozon, das wesentlichen Anteil am Fotosmog hat. Hier ist es nicht erwünscht, weil es Augen und Schleimhäute reizt und die Atmungsorgane schädigt.
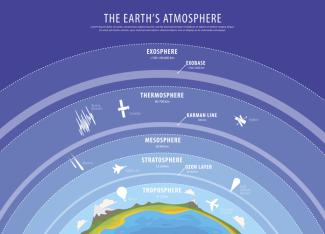
Die Schichtung der Atmosphäre ergibt sich durch verschiedene physikalische und chemische Prozesse in der Atmosphäre und ist von großer Bedeutung für die Verteilung der Stoffe in der Atmosphäre.
Die bis etwa 10 km reichende unterste Schicht ist die Troposphäre, in der sich fast das gesamte Wettergeschehen abspielt. In dieser Schicht sinkt die Temperatur mit zunehmender Höhe. In der darüberliegenden Stratosphäre steigt die Temperatur wieder an (Bild 1).
Ozon entsteht unter Einwirkung von UV-Strahlung in der Stratosphäre aus Disauerstoff und ist in geringer Konzentration in Höhen von 15-30 km über der Erdoberfläche vorhanden. Diese Ozonschicht in der Stratosphäre ist außerordentlich wichtig für den Erhalt des Lebens auf der Erde. Durch Absorption des energiereichen kurzwelligen Teils des ultravioletten Lichtes verhindert die Ozonschicht , dass biologisch schädliche Strahlung zur Erdoberfläche gelangt.
-
Die Atmosphäre ist aus mehreren Schichten aufgebaut.
shoo_arts - iStock
Die Bildung von bodennahem Ozon (Fotosmog)
Ozon ist aber auch natürlicher Bestandteil der bodennahen Atmosphäre, es gelangt z. B. aus der Stratosphäre in die Troposphäre. Der natürliche Gehalt von in Bodennähe ist viel kleiner als in der Stratosphäre. Der bodennahe Anteil beträgt nur 2-5 % des gesamten Ozongehalts der Atmosphäre.
Die Konzentration an bodennahem Ozon wird in µg/m³ Luft oder in ppm (1 ppm = 0,0001 Vol.-% = 2 µg Ozon pro m³ Luft) angegeben. Die ersten derartigen Messungen am Ende des 19. Jh. bei Paris erbrachten Werte um 20 µg/m³. Systematisch wird Ozon erst seit wenigen Jahrzehnten auch in Deutschland mit vielen automatischen Messstationen erfasst. Dabei zeigt sich, dass die Jahresmittelwerte überall in letzter Zeit ansteigen.
Dieser Anstieg der bodennahen Ozonkonzentration wird zwar ebenfalls durch menschliche Aktivitäten verursacht, steht jedoch in keinem Zusammenhang zum Ozonloch in den höheren Schichten der Atmosphäre.
Besonders im Sommer kann die Konzentration von bodennahem Ozon von unter 50 µg/m³ auf Werte über 200 µg/m³ zunehmen. Dabei wird Ozon gar nicht direkt freigesetzt, sondern bildet sich unter Einfluss der Sonnenstrahlung fotochemisch aus Vorläufersubstanzen, wie Stickstoffoxiden, Kohlenstoffmonooxid und Kohlenwasserstoffen. Neben Ozon entstehen dabei auch andere Schadstoffe, die zusammen den gesundheitsschädlichen Fotosmog bilden. Im Gegensatz zum stratosphärischen Ozon ist bodennahes Ozon schädlich.
Quelle der Vorläufermoleküle des Ozons sind insbesondere Autoabgase. Sie enthalten bis zu 10 000 ppm CO, 100 bis 8 000 ppm 200 ppm und bis zu 500 ppm Aromaten und 400 ppm Aldehyde.
Die Reaktionswege bei der Umwandlung der Vorläufersubstanzen zum Fotosmog sind sehr komplex und vielfältig. Auf einem dieser Wege wird NO unter Beteiligung von CO zu oxidiert. Das Sonnenlicht spaltet entstandenes wieder in NO und atomaren Sauerstoff. Dieser bildet dann mit molekularem Sauerstoff Ozon.
In einem zweiten Weg werden aus Kohlenwasserstoffen und Sauerstoff unter Beteiligung von Aldehyde und Ozon gebildet. Die Aldehyde unterliegen z. T. noch weiteren Folgereaktionen.
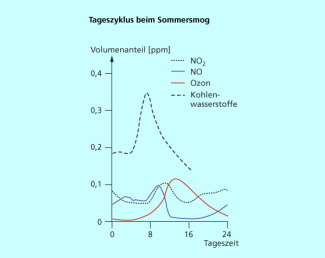
Der Fotosmog tritt besonders an warmen Sommertagen auf. Dabei durchläuft die Konzentration der Schadstoffe charakteristische Tageszyklen (Bild 3). Durch Reaktion, z. B. mit NO und Kohlenwasserstoffen, wird Ozon nachts wieder abgebaut.
Der Wind transportiert und Ozon aber auch vom Bildungsort in sogenannte Reinluftgebiete. Da dort wenig Autoverkehr ist und deshalb weniger Stickstoffoxide und Kohlenwasserstoffe in der Luft vorhanden sind, ist nachts der Ozonabbau geringer. Die Ozonkonzentration kann dann in den Reinluftgebieten höher als in den Ballungsgebieten sein.
Zum Schutz der menschlichen Gesundheit und der Vegetation gibt es gesetzliche Schwellenwerte für Ozon.
- Schwellenwert für Gesundheitsschutz:
110 µg/m³ als Mittelwert über 8 h - Schwellenwert für Unterrichtung der Bevölkerung:
180 µg/m³ als Mittelwert über 1 h - Schwellenwert für Einschränkung des Autoverkehrs:
240 µg/m³ als Mittelwert über 1 h - Schwellenwert für Warnung der Bevölkerung:
360 µg/m³ als Mittelwert über 1 h - Schwellenwert für Schutz der Vegetation:
65 µg/m³ als Mittelwert über 24 h - Schwellenwert für Schutz der Vegetation:
200 µg/m³ als Mittelwert über 1 h
Die Überschreitung der Schwellwerte mit Gefahren für die menschliche Gesundheit ist zwar in den letzten Jahren weniger häufig vorgekommen, dafür werden aber die Schwellwerte zum Schutz der Vegetation öfter überschritten. Bei einigen ozonempfindlichen Nutzpflanzen (Weizen, Bohne Klee) wurden Ertragsminderungen durch erhöhte Ozonkonzentrationen nachgewiesen, bei anderen (Hafer, Roggen, Gerste) werden sie vermutet.
-
Die Änderungen der Volumenanteile sind durch verschiedene chemische Reaktionen bedingt.