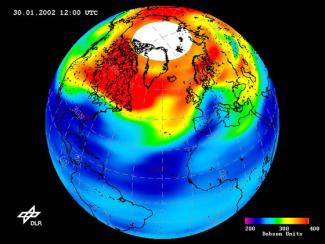
Ozonloch
Ozon ist eine dreiatomige Modifikation des Sauerstoffs und chemisch viel reaktiver als der viel häufiger vorkommende Disauerstoff. Ozon besitzt einen charakteristischen Geruch, den man z. B. gut in Copyshops wahrnehmen kann.
Es entsteht z. B. in der oberen Atmosphäre unter Einwirkung von UV-Strahlung aus Sauerstoffmolekülen und bildet die schützende Ozonschicht der Erde. Diese ist für uns wichtig, weil sie biologisch schädliche UV-Strahlung von der Erdoberfläche fernhält.
Durch verschiedene Spurengase in der Atmosphäre wird Ozon teilweise abgebaut, sodass in den letzten 30 Jahren die Ozonkonzentration um ca. 10% gesunken ist. Über den Polkappen der Erde wird seit 1985 zu bestimmten Jahreszeiten eine regional begrenzte, viel stärkere Abnahme des Ozongehalts - das sogenannte Ozonloch - registriert.
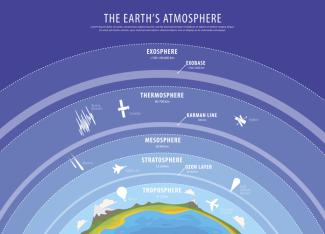
Die Schichtung der Atmosphäre ergibt sich durch verschiedene darin ablaufende physikalische und chemische Prozesse und ist von großer Bedeutung für die Verteilung der Stoffe in der Atmosphäre.
Die bis etwa 10 km reichende unterste Schicht ist die Troposphäre, in der sich fast das gesamte Wettergeschehen abspielt. In dieser Schicht sinkt die Temperatur mit zunehmender Höhe. In der darüberliegenden Stratosphäre steigt die Temperatur wieder an (Bild 1).
Ozon ist ein Gas, dass sich in geringer Konzentration hauptsächlich in Höhen von 15-30 km über der Erdoberfläche befindet.
Wenn man in einem Gedankenexperiment das gesamte Ozon, das sich von der Erdoberfläche bis zum Weltall in der Atmosphäre befindet, allein in reiner Form an die Erdoberfläche bringen könnte, ergibt das nur eine ganz dünne Schicht von 3-5 mm Dicke unter Normaldruck. Die Ozonmenge, die einer solchen Schicht von 1 mm reinem Ozon entspricht, wird mit 100 DOBSON-Einheiten gleichgesetzt, zu Ehren des britischen Pioniers in der Ozonforschung DOBSON. Die Ozonschichtdicke der Erde beträgt somit normalerweise jahreszeitlich und geografisch schwankend 300-500 Dobson.
Ozon in der Stratosphäre
In der Stratosphäre wird durch Fotolyse von molekularem Sauerstoff Ozon gebildet. Die energiereiche UV-Strahlung der Sonne spaltet in der Stratosphäre Sauerstoffmoleküle in Atome, die mit weiteren Sauerstoffmolekülen Ozon bilden. Da die Spaltung durch Einwirkung von Strahlung angeregt wird, spricht man von einer fotochemischen Reaktion oder Fotolyse.
-
Die Atmosphäre ist aus mehreren Schichten aufgebaut.
shoo_arts - iStock
Ozonbildung:
Das fotochemisch gebildete Ozon wird ebenfalls durch Strahlung unter Rückbildung von molekularem Sauerstoff wieder gespalten. Durch die fotochemischen Reaktionen wird kurzwellige UV-Strahlung absorbiert und verhindert, dass diese biologisch schädliche Strahlung zur Erdoberfläche gelangt.
Ozonzerfall:
-
Disauerstoff und Trisauerstoff (Ozon) sind Modifikationen des gleichen Elements.

Zwischen Ozonbildung und -zerfall stellt sich ein Gleichgewicht ein. Somit ergibt sich eine ständige Ozonschicht in der Stratosphäre mit nahezu gleichbleibender Ozonkonzentration. Erst die Herausbildung dieser Ozonschicht ermöglichte die Entstehung des Lebens – wie wir es heute kennen – außerhalb der Ozeane (Wasser absorbiert ebenfalls die schädliche UV-Strahlung, sodass sich Wasserorganismen schon früher entwickeln konnten).
Im Bereich des Äquators, wo die Sonnen besonders intensiv strahlt, entsteht naturgemäß am meisten Ozon in der Atmosphäre. Durch Luftströmungen gelangt Ozon jedoch auch zu den Polen der Erde.
Das stratosphärische Ozon kann aber durch verschiedene Stoffe auch chemisch abgebaut werden. Dabei läuft eine Reaktionskette ab, in der diese Stoffe wieder zurückgebildet werden und somit katalytisch weitere Ozonmoleküle spalten können.
Chemischer Ozonabbau:
Die Ozon zerstörenden Stoffe, z. B. sind teilweise natürlichen Ursprungs. Der chemische Ozonabbau wird aber anthropogen besonders durch die Emission von Fluorchlorkohlenwasserstoffen verstärkt.
Die FCKW, z. B. werden in der Troposphäre nicht abgebaut und wandern langsam in die Stratosphäre. Erst hier erfolgt ihre ebenfalls fotolytische Spaltung. Dabei entstehen Chloratome (Radikale), die das natürliche Ozongleichgewicht stören.
Die Chloratome, aber auch andere Radikale, reagieren mit dem Ozon nach folgendem Schema:
Ein Chloratom kann diesen katalytischen Zyklus mehrere Tausend mal durchlaufen und ebenso viele Ozonmoleküle abbauen. Die gleiche Gefahr geht von Stickstoffoxiden aus, die aus Flugzeugabgasen stammend in die Stratosphäre gelangen. Daraus resultiert ein kontinuierlicher Abbau des Ozons in der Stratosphäre durch anthropogene Einflüsse.
Die stratosphärische Ozonschicht wurde dadurch in den letzten 30 Jahren zwischen 60° Süd und 60° Nord um etwa 10 % reduziert, sodass entsprechend mehr biologisch schädliche UV-Strahlung auf die Erdoberfläche gelangt. Diese kontinuierliche Abnahme kann aufgrund der hohen Stabilität und damit langen Verweildauer der FCKW (Freone) in der Stratosphäre nicht ohne weiteres zum Stillstand gebracht werden. Selbst wenn ab sofort keine FCKW und Stickstoffoxide mehr in die Stratosphäre gelangten, würde es mindestens 30 Jahre dauern, bis die Ozonkonzentration wieder ansteigt.
Das Ozonloch
1986 stellten britische Wissenschaftler bei der Auswertung von Satellitenaufnahmen fest, dass sich die Dicke der in der Atmosphäre vorhandenen Ozonschicht mit der Jahreszeit verändert und über der Antarktis zeitweise regelrechte Löcher in dieser Schicht auftraten. In den letzten Jahren wurde eine Vergrößerung dieser Löcher über der Antarktis und über der Arktis festgestellt (Bild 3). Ursache für diese plötzliche starke Verminderung der Ozonschicht in den Polargebieten sind Wolken, die dort in der Stratosphäre vorhanden sind. Diese enthalten auch Salpetersäure und haben im Winter Temperaturen bis unter –70 °C. Unter diesen Bedingungen werden die in der Atmosphäre vorhandenen Chloratome wie auch andere Moleküle an der Wolkenoberfläche adsorbiert, wobei dann auch verschiedene chemische Reaktionen ablaufen. Dadurch ist die Konzentration an Chloratomen im Gasraum so stark vermindert, dass das Ausmaß des Ozonabbaus durch das Chlor dann gering ist.
Wenn die Wolken dann mit Beginn des Frühjahrs durch die Sonne erwärmt werden, wird das adsorbierte Chlor wieder in großen Mengen freigesetzt und führt zu einem sehr starken Ozonabbau. Diese Ozonlöcher werden dann im Frühling durch die Zufuhr ozonreicher Luft vom Äquator wieder aufgefüllt und bilden sich am Ende des folgenden Winters neu.
Als Ozonloch wird die drastische Abnahme der Ozonkonzentration in der Stratosphäre bezeichnet, die zu Beginn des Frühjahrs in den Polargebieten auftritt. Von einem Ozonloch spricht man, wenn sich auf der Erdoberfläche die Intensität der kurzwelligen UV (B)-Strahlung gegenüber dem normalen Wert verdoppelt. Dadurch erhöht sich das Krebsrisiko und die Beeinträchtigung des Wachstums lebender Zellen erheblich.
So wird z. B. durch UV (B)-Strahlung das Plankton im Meer geschädigt, stirbt ab oder vermehrt sich weniger gut. Da Plankton eines der ersten Glieder in einer längeren Nahrungskette ist, hat seine Verminderung Auswirkungen auf den Fischreichtum und damit letztendlich auf die Ernährung des Menschen.
-
Ozonloch über der Antarktis 2009