Galvanische Elemente
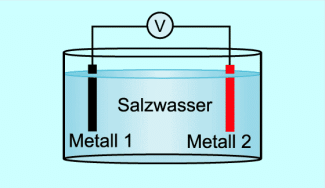
Galvanische Quellen (Galvanische Zellen) sind Vorrichtungen die aus einer Anode (minuspol), einer Katode (Pluspol) und einem Elektrolyt bestehen und die auf der Grundlage elektrochemischer Reaktionen (Reduktions-Oxidations-Prozesse) elektrische Energie liefern. Damit ist die Nutzung elektrischer Energie unabhängig vom elektrischen Festnetz möglich.
Galvanische Elemente sind nach dem italienischen Mediziner LUIGI GALVANI benannt. Sie bestehen aus zwei miteinander verbundenen aber räumlich getrennten elektrochemischen Halbzellen, in denen jeweils eine Elektrode in einen Elektrolyten eintaucht. Sie dienen der netzunabhängigen Stromversorgung, wobei an den Elektroden Redoxprozesse ablaufen und somit bei der Entladung chemische Energie in elektrische umgewandelt wird, die über einen äußeren Stromkreis nutzbar ist.
An der Katode findet dabei eine Reduktion statt. Es werden Elektronen von der Elektrode an ein Teilchen in der Lösung abgegeben. Die Anode nimmt Elektronen von einem gelösten Teilchen auf, das damit oxidiert wird.
Es gibt verschiedene Arten von galvanischen Elementen.
In Primärelementen laufen diese Reaktionen an den Elektroden irreversibel ab, bei Stromentnahme werden die Stoffe verbraucht. Primärelemente, die auch als Batterien bezeichnet werden, kann man daher nicht wieder aufladen. Durch die Umwandlung von Anoden- oder Katodenmaterial bei der elektrochemischen Reaktion wird oft der konstruktive Aufbau der Zelle ungünstig beeinflusst. Ihre Lebensdauer ist damit begrenzt.
Akkumulatoren sind solche galvanischen Elemente, bei denen die Redoxprozesse an den Elektroden reversibel sind. Sie können durch Anlegen einer Spannung nach der Entladung wieder aufgeladen werden. Die freiwilligen Reaktionen, die an den Elektroden beim Entladen ablaufen, laufen beim Laden zwangsweise in umgekehrter Richtung ab. Sie werden daher auch als Sekundärelemente bezeichnet. Im Idealfall kann dieser Entlade-Lade-Zyklus beliebig oft wiederholt werden. In der Praxis ist das aber nicht möglich.
Bei den Brennstoffzellen werden Flüssigkeiten oder Gase an den Elektroden oft in einer irreversiblen Reaktion umgesetzt. Durch die Reaktion wird aber im Unterschied zu Batterien der konstruktive Aufbau der Zelle nicht beeinträchtigt. Da die an den Elektroden umgesetzten Stoffe kontinuierlich nachgeliefert und die entstehenden Produkte auch kontinuierlich von den Elektroden abtransportiert werden können, haben Brennstoffzellen im Gegensatz zu Batterien theoretisch eine unbegrenzte Lebensdauer.
Die mithilfe galvanischer Elemente erzeugte elektrische Energie ist wesentlich teurer als die aus dem Festnetz zu entnehmende Energie. Der große Vorteil ist aber die Ortsunabhängigkeit. Eine Kilowattstunde (kWh) Batteriestrom kostet bis zu 4 000 Euro. Sekundärelemente, die mehrere hundert Zyklen durchlaufen, liefern den Strom wesentlich kostengünstiger (5-10 Euro pro kWh)
Bei der Entwicklung und Nutzung galvanischer Elemente war und ist man häufiger auf die Verwendung toxischer Metalle (Blei, Cadmium, Quecksliber, Nickel) angewiesen. Werden große Anlagen mit diesen Metallen betrieben, so ist die umweltschonende Aufarbeitung und Rückgewinnung problemlos möglich. Schwierig gestaltet sich die vollständige Rückführung gebrauchter Batterien im Privatsektor. Ziel ist es, umweltfreundliche chemische Prozesse zu nutzen, sodass ein Rückführungsverlust ökologisch vertretbar ist.
-
Einfaches galvanisches Element
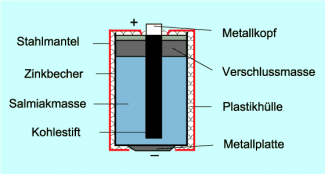
Ein wichtiges galvanisches Primärelement ist das Leclanché-Element, benannt nach dem französischen Chemiker GEORGES LECLANCHÉ (1839-1882).
Am Minuspol dieses Elements (Anode) erfolgt die Oxidation von Zink.
Am Pluspol des Leclanché-Elements (Katode) erfolgt die Reduktion von Mangan(IV)-oxid zu Mangan(III)-oxid.
Weitere wichtige Primärelemente sind:
- Zink-Manganoxid-Zelle
- Lithium-Batterie
- Alkali-Mangan-Zelle
- Silber-Zink-Zelle
Bedeutende Sekundärelemente (Akkumulatoren) sind:
- Bleiakkumulator
- Nickel-Cadmium-Akkumulator
- Nickel-Metallhydrid-Akkumulator
- Lithium-Ionen-Akkumulator
Nach wie vor hat der robuste, 1859 von GASTON PLANTÉ (1834-1924) entwickelte Bleiakkumulator eine große Bedeutung in der Praxis.
Die komplizierten Reaktionen lassen sich in einer vereinfachten Bruttoreaktionsgleichung zusammenfassen.
Auch der im Jahr 1899 vom Schweden WALDEMAR JUNGENER (1869-1924) entwickelte Nickel-Cadmium-Akkumulator ist im EInsatz. Die Gesamtreaktion lässt sich wie folgt formulieren, wobei Kalilauge als Elektrolyt verwendet wird.
Aus Gründen des Umweltschutzes ist allerdings die Verwendung von Cadmium in den letzten Jahren eingeschränkt worden.
Große Bedeutung, besonders bei Elektrostraßenfahrzeugen, in der Luft- und Raumfahrt, haben die Nickel-Metallhydrid-Akkumulatoren erlangt. Sie zeichnen sich durch eine hohe Zyklenzahl und grosse Speicherkapazität aus. Als negativ geladenen Anode dient eine Nickel-Lanthan-Legierung in deren Gitter Wasserstoff drucklos gespeichert vorliegt, sodass sich etwa die Zusammensetzung LaNiH (Metallhydrid MH) ergibt. Stakt vereinfacht lässt sich die Gesamtreaktion folgendermaßen angeben.
Kleine Akkumulatoren sollten leicht sein, eine hohe Speicherkapazität haben und keine umweltschädigenden Metalle enthalten. Die höchste Speicherkapazität weisen derzeit die Lithium-Ionen-Akkumulatoren auf.
Brennstoffzelle
Brennstoffzellen arbeiten mit einem hohen Wirkungsgrad und bei Arbeitstemperaturen von ca. 80 °C. Es erfolgt die direkte Umwandlung chemischer in elektrische Energie z. B. durch kontrollierte Verbrennung von Wasserstoff oder Erdgas an geeigneten Katalysatoren in einem alkalischen Elektrolyten. Die Reaktionen lassen sich durch folgende Gleichungen darstellen. An die Reinheit der Gase werden hohe Anforderungen gestellt.
-
Aufbau einer Monozelle (Leclanché-Element)
Suche nach passenden Schlagwörtern
- Knopfzelle
- Batterie
- Volta-Element
- Leclanchè> Georges
- voltasche Säule
- Alessandro Volta
- elektrochemischen Spannungsreihe
- elektrochemische Zellen
- Stromquelle
- Alkali-Mangan-Element
- Flachbatterie
- galvanische Elemente
- Leclanché-Element
- Elektrode
- Elektrische Quelle
- Luigi Galvani
- Elektrolyt
- Spannungsquelle
- Elektrolyte

