Glas
Glas ist ein fester, durchsichtiger Werkstoff, der hauptsächlich aus Siliciumdioxid besteht. Durch Optimierung der Zusammensetzung und der Bedingungen der Herstellung können die Eigenschaften von Silicatgläsern so beeinflusst werden, dass der Werkstoff für vielseitig einsetzbar ist.
Deshalb nutzt man Glas als Baustoff, als Verpackungsmaterial, als Laborglas oder auch als Material für Glasfasern und für viele andere Zwecke.
Eigenschaften und Aufbau
Glas ist seit etwa 4 000 Jahren bekannt. Seine Bedeutung als Werkstoff liegt in zahlreichen günstigen Eigenschaften wie der Lichtdurchlässigkeit, der vielfältigen Möglichkeit der Form- und Farbgebung und der Beständigkeit gegenüber den meisten Chemikalien. Glas hat eine geringe Wärmeleitfähigkeit und ist ein elektrischer Isolator.
Beim Erhitzen wird Glas zunächst zäh und dickflüssig und geht dann in den flüssigen Aggregatzustand über. In der Schmelze lässt sich Glas zu vielfältigen Formen verarbeiten (pressen, blasen, walzen usw.), und durch verschiedene Zusätze kann man die Eigenschaften beeinflussen.
Nachteilig ist aber, dass viele Gläser bruchempfindlich sind und eine geringe Temperaturwechselbeständigkeit haben: sie zerspringen beim schnellen Abkühlen oder Erhitzen.
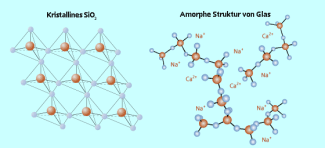
Unter einem Glas versteht man im Allgemeinen einen nichtkristallinen (amorphen) Feststoff. Nach dem Teilchenmodell kann man Gläser als eingefrorene Schmelze auffassen, in der im Gegensatz zu den kristallinen Stoffen mit regelmäßiger Anordnung der Bausteine im Glas diese unregelmäßig angeordnet sind. Während kristalline Feststoffe einen scharfen Schmelzpunkt aufweisen, erweichen Gläser beim Erwärmen und können in diesem Zustand leicht verformt werden.
Die wichtigsten Gläser, die uns im Alltag und in der Technik als Werkstoffe begegnen, sind Silicatgläser.
Im Gegensatz zu den kristallinen Silicaten mit regelmäßiger Verknüpfung der -Bausteine besteht Glas aus einem unregelmäßigem Netzwerk von -Bausteinen, in dessen „Maschen“ sich unterschiedliche Kationen (Na, Ca und andere) befinden (Bild 2).
Zusammensetzung
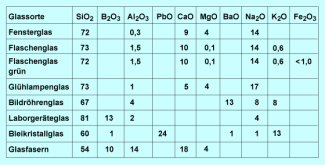
Die Eigenschaften der Gläser hängen von ihrer Zusammensetzung und von den Besonderheiten der Herstellung sowie der thermischen Vorgeschichte ab. Hauptbestandteil der Silicatgläser ist Siliciumdioxid, das in Form von Quarzsand als Rohstoff in großen Mengen zur Verfügung steht.
Normalglas, wie Fensterglas und Behälterglas, ist ein sogenanntes Natron-Kalk-Glas. Wird Natrium durch Kalium ersetzt, verbessert sich u. a. die chemische Beständigkeit.
Durch die Zugabe anderer Komponenten – meist in oxidischer Form – kann man zahlreiche Spezialgläser herstellen.
Der Zusatz von Aluminiumoxid und Boroxid verringert die thermische Ausdehnung und verbessert damit die Temperaturwechselbeständigkeit. Dieses Glas wird daher zur Herstellung von Laborgeräten verwendet.
-
Struktur von kristallinem Siliciumdioxid (links) und ungeordnete Netzwerkstruktur von Glas (rechts)
Bleireiche Gläser haben einen hohen Brechungsindex und werden für dekorative Zwecke genutzt (Bleikristallglas).
Optische Gläser sind besonders zusammengesetzte Spezialgläser.
Glas aus reinem Siliciumdioxid (Quarzglas) hat eine besonders hohe thermische und chemische Beständigkeit.
Auch die Farbigkeit von Gläsern wird durch Zusatz verschiedener Metalloxide verursacht. So färbt z. B. Eisenoxid das Glas grün oder braun.
| Einige Glassorten – ihre Eigenschaften und ihre Verwendung | |||
Glasssorte | Rohstoffe | ausgewählte Eigenschaften | Einsatzgebiete |
| Normalglas | Quarzsand, | erweicht bei 500 bis 600 °C, gegen viele Chemikalien beständig, jedoch nicht gegen Laugen | Fensterglas, Flaschen und andere Behälter |
| Bleiglas Kristallglas (Bleikristall) | Quarzsand, Bleioxid, Kalium- carbonat | hohe Lichtbrechung „Kristallglanz“ | für geschliffene Glasgegenstände, Glasschmuck |
| Borosilicat-glas | Quarzsand, Aluminium- oxid Boroxid, Bariumoxid | geringe Wärmeausdehnung, gegen Laugen bedingt beständig | feuerfeste Küchengeräte, Laborgeräte |
| Quarzglas | Quarzsand | hohe thermische und chemische Beständigkeit, keine Absorption von UV-Strahlung | optische Bauelemente und Spezialgläser, temperatur- und säurebeständige Geräte und Apparaturen |
Herstellung
Die Herstellung von Glas erfolgt in zwei Hauptstufen:
- Gewinnung der Glasschmelze aus den Ausgangsstoffen
- Herstellung der gewünschten Form (Flachglas, Hohlglas, Fasern)
Die Gewinnung der Schmelze soll am Beispiel von Flaschenglas erläutert werden. Die Rohstoffe hierfür sind Quarzsand (sehr reines Siliciumdioxid), Kaolin (), Natriumcarbonat (Soda, ) und Calciumcarbonat (Kalk, ). Dieses enthält oft geringe Mengen an Magnesiumcarbonat.
Die Rohstoffe werden fein gemahlen, getrocknet und dann in beheizten Wannenöfen bei Temperaturen zwischen 800 °C und 1 100 °C geschmolzen. Zur Beschleunigung des Schmelzvorganges setzt man bis zu 30 % Glasbruch zu. Bei diesen Temperaturen spalten Natriumcarbonat und Calciumcarbonat Kohlenstoffdioxid ab, das aus der Schmelze entweicht. Dann wird die Schmelze auf ca. 1 400 °C aufgeheizt, damit sie dünnflüssiger wird und somit das Kohlenstoffdioxid vollständig ausgetrieben wird (Läuterung). Danach lässt man auf 900-1 200 °C abkühlen, bei diesen Temperaturen erfolgt die Formgebung.
Zur Herstellung von Flachglas gibt es hautsächlich 3 Varianten:
- Die Glasschmelze wird mit Walzen ausgewalzt.
- Die Glasmasse wird aus der Schmelze durch eine Schlitzdüse nach oben gezogen.
- Die Glasschmelze wird auf flüssiges Zinn (Schmelzpunkt von 232 °C) gegossen und erstarrt. Dabei wird die Oberfläche besonders glatt (Floatglas, Spiegelglas).
Für die Herstellung von Hohlglas gibt es ebenfalls mehrere Möglichkeiten:
- Die Glasschmelze wird in Formen gepresst.
- Glastropfen fallen in eine Vorform und werden dann in die Fertigform geblasen.
- Die Glasschmelze wird mit hoher Drehzahl in die Form geschleudert (z. B. Konus von Bildröhren für Fernsehgeräte).
Zur Herstellung von Glasfasern wird z. B. die Glasschmelze durch Düsen gepresst. Kompliziert geformte Glasteile werden dagegen auch heute noch mit dem Mund geblasen und manuell zusammengesetzt.
Recycling
Glas gehört zu den Werkstoffen, die nahezu unbegrenzt wiederverwendet werden können. Das Erfassen und Verwerten von Altglas entlastet nicht nur die Müllentsorgung, sondern spart auch Rohstoffe und Energie. Bei der Verwertung von Altglas benötigt man bis zu 40 % weniger Energie. Der Zusatz von 1 % Altglas-Scherben zu den Rohstoffen senkt den Energieverbrauch bereits um 0,3 %. Weiterhin verbessert der Zusatz von Altglas-Scherben zum „normalen“ Rohstoffgemisch das Schmelzverhalten, indem der Schmelzpunkt herabgesetzt wird.
Wichtig für die Herstellung von farblosem Glas aus Altglas ist die strikte Vermeidung von Grün- oder Braunglasanteilen in den Altglasscherben. In der BRD werden über 4 Mio. t Behälterglas und etwa 1,5 Mio. t Flachglas produziert.
Die Altglassammlung ergibt etwa 2,3 bis 2,4 Mio. t Behälterglas, die zu 88 % (2004) verwertet wurden, bei Flachglas wurden 300 000 t wiederverwertet.
-
Chemische Zusammensetzung einiger Gläser in Masse- bzw. Gew.-%