Größen in der Chemie
Größen sind spezielle Fachbegriffe. Sie unterscheiden sich von anderen Fachbegriffen dadurch, dass es Begriffe zur Beschreibung messbarer Eigenschaften von Objekten sind. Neben der Bedeutung der Größe, die wie bei anderen Begriffen definiert wird, kann für ein konkretes Objekt auch der Wert der Größe angegeben werden. Dazu ist die Festlegung einer Einheit erforderlich. Außerdem ist für jede Größe ein Formelzeichen als Abkürzung festgelegt. Darüber hinaus gehört zur vollständigen Charakterisierung einer Größe die Angabe eines Messgerätes oder eines Messverfahrens zur Bestimmung des Wertes der Größe.
Einen Teil der naturwissenschaftlichen Begriffe bezeichnet man als Größen.
Eine Größe beschreibt ein quantitativ bestimmbares Merkmal einer Klasse von Objekten, Zuständen oder Vorgängen. |
Der Begriff quantitativ wird aus dem Lateinischen von quantitas = Größe, Anzahl abgeleitet und bedeutet mengenmäßig bzw. zahlenmäßig.
Die Mehrzahl der wichtigen Größen in der Chemie beschreiben physikalische Eigenschaften von Stoffen und werden deshalb physikalische Größen genannt.
-
Der Messzylinder ist ein Messinstrument zur Bestimmung des Volumens.

Heinz Mahler, Berlin
Wie jeder andere Fachbegriff wird eine Größe durch ihre Bedeutung gekennzeichnet. Die Bedeutung der Größe gibt an, welche Eigenschaft der Objekte beschrieben wird.
| Beispiel: Das Volumen gibt an, wie viel Raum eine Stoffprobe oder Stoffportion einnimmt. |
Neben der Bedeutung der Größe kann für ein konkretes Objekt auch der Ausprägungsgrad der Eigenschaft quantitativ gemessen und angegeben werden. Man nennt diesen Ausprägungsgrad auch Wert der Größe. Dazu ist die Festlegung einer Einheit erforderlich. Der Wert einer Größe ist das Produkt aus Zahlenwert und Einheit.
| Beispiel: Die Einheit des Volumens ist ein Liter (1 l). Für eine Flüssigkeit (z. B. Wasser) kann dann der Wert des Volumens angegeben werden, z. B.: Das Wasser hat ein Volumen von 120 ml. |
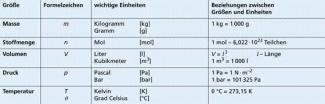
Für jede Größe ist ein (in einigen Fällen auch mehrere) Formelzeichen festgelegt, mit denen man naturwissenschaftliche Gesetze mathematisch formulieren und handhaben kann. Darüber hinaus gehört zur vollständigen Charakterisierung einer Größe die Angabe eines Messgerätes (Bild 1) oder eines Messverfahrens zur Bestimmung des Wertes der Größe.
| Beispiel: Für das Volumen ist das Formelzeichen V vereinbart. Man kann das Volumen mithilfe von Messzylindern direkt messen oder durch die Verdrängungs- oder Differenzmethode ermitteln. |
In der nachfolgenden Übersicht sind einige weitere Beispiele für die Kennzeichnung von Größen genannt.
Größe | Temperatur | Dichte |
| Formelzeichen | ||
| Bedeutung | Die Temperatur gibt an, wie warm oder wie kalt ein Körper ist. | Die Dichte gibt an, welche Masse ein Kubikzentimeter eines Stoffes hat. |
| Einheiten | 1 Grad Celsius (1 °C) 1 Kelvin (1 K) | 1 Gramm je Kubikzentimeter |
| Messgerät | Thermometer | Aräometer |
| Berechnung |
Bei den Größen kann man auch zwischen Zustandsgrößen und Prozessgrößen unterscheiden.
-
Quantitative Größen in der Chemie