Isomerie von Komplexverbindungen
Chemische Verbindungen sind isomer, wenn sie in ihrer Summenformel übereinstimmen, sich aber in der Struktur unterscheiden. Aufgrund dieses Umstandes besitzen Isomere in der Regel unterschiedliche chemische und physikalische Eigenschaften. In der anorganischen Chemie treten Isomere insbesondere bei Komplexverbindungen auf, wobei hauptsächlich vier Hauptisomerieformen unterschieden werden, Konfigurationsisomerie, Bindungsisomerie, Ionenisomerie und Koordinationsisomerie. Sie alle beruhen auf unterschiedlicher Anordnung der Liganden um das Zentralion oder darauf, dass diese in verschiedenen stöchiometrischen Verhältnissen an das Zentralion gebunden sind.
Komplexe (Koordinationsverbindungen) bestehen aus einem Zentralteilchen und anorganischen oder organischen Liganden, die die Ligandenhülle bilden.
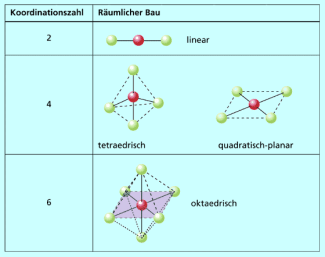
Die Koordinationszahl (KZ) gibt die Anzahl der Liganden an, die an das Zentralteilchen gebunden sind und bedingt die räumliche Anordnung der Liganden um das Zentralteilchen. Die häufigsten Koordinationszahlen sind 2 (linear), 4 (tetraedrisch oder quadratisch-planar) und 6 (oktaedrisch).
Bildet sich eine Komplexverbindung aus verschiedenen Liganden, oder liegen verschiedene Liganden in einem Komplex vor, können unterschiedliche Isomere auftreten.
-
Räumlicher Bau von Komplexen mit unterschiedlichen Koordinationszahlen
Isomerie
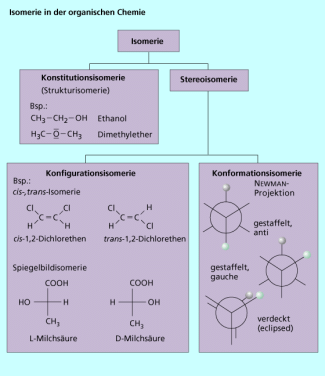
Sind am Aufbau von zwei chemischen Verbindungen die gleichen Atome in gleicher Zahl beteiligt, die Atome aber unterschiedlich angeordnet, spricht man in der Chemie von Isomerie . Isomere Verbindungen besitzen also die gleiche Summenformel, jedoch eine unterschiedliche Struktur und deshalb verschiedene chemische und physikalische Eigenschaften.
Eine wichtige Art der Isomerie - insbesondere in der organischen Chemie - ist die Strukturisomerie (Konstitutionsisomerie), bei der die Atome auf unterschiedliche Weise miteinander verknüpft sind. Hierzu gehören z. B. die Stellungsisomerie oder die Doppelbindungsisomerie. Ebenfalls von großer Bedeutung ist die Stereoisomerie, bei der die räumliche Struktur der Moleküle unterschiedlich ist, das Grundgerüst, d. h. die Verknüpfung der Atome jedoch gleich (Bild 2).
Bei Komplexverbindungen treten verschiedene Formen der Isomerie auf, die sich zum Teil mit denen in der organischen Chemie decken, zum Teil aber von ihnen unterscheiden.
-
Verschiedene Arten von Isomerie bei organischen Molekülen
Konfigurationsisomerie (Stereoisomerie)
Stereoisomere Komplexe besitzen dieselbe Konstitution (Verknüpfung der Atome), aber einen unterschiedlichen räumlichen Aufbau. Der Konfigurationsisomerie werden drei Untergruppen zugeordnet.
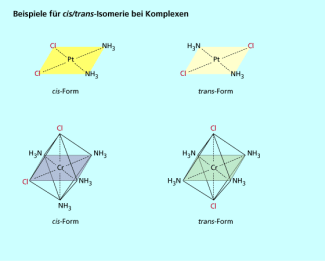
Bei quadratisch-planaren und oktaedrischen Komplexen kann die cis/trans-Isomerie auftreten, wenn in dem Komplex verschiedene Liganden gebunden sind, von denen einer doppelt vorhanden ist (Bild 3). Stehen die gleichen Liganden sich gegenüber, handelt es sich um die trans-Form, stehen sie nebeneinander, liegt die cis-Form vor. sind zwei Beispiele für diese Art der Isomerie. Bei tetraedrischen Komplexen ist die cis-trans-Isomerie unmöglich.
-
Beispiele für cis/trans-Isomerie bei Komplexen
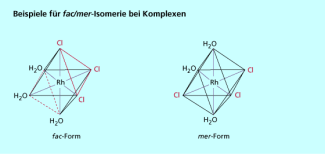
Eine weitere Art der Stereoisomerie ist die fac/mer-Isomerie , die bei oktaedrischen Komplexen auftritt, wenn zwei verschiedene Liganden jeweils dreimal an das Zentralatom gebunden sind (Bild 4). Von facial (von lat. facies = Gesicht) spricht man, wenn jeweils drei gleiche Liganden sich als Fläche gegenüberstehen, von meridional (von lat. meridianus = südlich, Äquator), wenn drei gleiche Liganden äquatorial stehen. Dies ist zum Beispiel bei dem Komplex der Fall.
-
Beispiel für fac/mer-Isomerie bei Komplexen
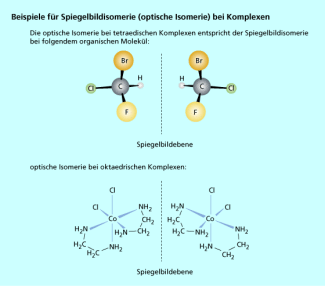
Die dritte Untergruppe der Stereoisomerie ist die Spiegelbildisomerie (optische Isomerie), welche eine wichtige Form der Isomerie bei organischen Molekülen ist, zum Beispiel bei den Aminosäuren und den Kohlenhydraten. Die optische Isomerie tritt in tetraedrischen und oktaedrischen Komplexen auf, die sich wie Bild und Spiegelbild verhalten und nicht zur Deckung gebracht werden können. In der richtigen räumlichen Orientierung kann man eine Spiegelebene zwischen beide Komplexe legen (Bild 5). Die Vertreter der optischen Isomere sind die einzigen, welche identische physikalische und chemische Eigenschaften aufweisen, bis auf die Tatsache, dass sie die Schwingungsebene von linear polarisiertem Licht in entgegengesetzte Richtungen, aber um den gleichen Betrag drehen.
-
Beispiele für Spiegelbildisomerie (optische Isomerie) bei Komplexen
Bindungsisomerie (Salzisomerie)
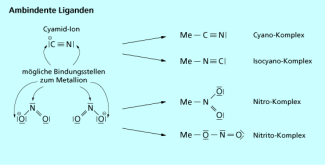
Die Bindungsisomerie tritt auf, wenn Liganden alternativ von zwei Atomen aus die koordinative Bindung zum Zentralteilchen ausbilden können. Zu diesen sogenannten ambidenten Liganden gehören z. B. Nitrit Cyanid oder Thiocyanat .
Die entstehenden isomeren Verbindungen werden Bindungsisomere genannt (Bild 6). Für den Komplex mit der Summenformel gibt es zwei verschiedene Isomere: das rote Pentaamminnitrocobalt(III)-chlorid und das gelbe Pentaamminnitritocobalt(III)-chlorid . Mithilfe der Infrarotspektroskopie kann man nachweisen, ob der Ligand über das Stickstoff- oder das Sauerstoffatom am Zentralteilchen koordiniert ist.
-
Ambidente Liganden haben zwei Haftatome, mit denen sie sich an das Zentralion binden können.
Ionenisomerie
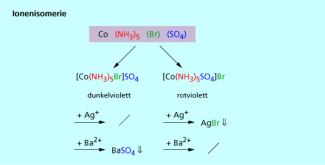
In einem auskristallisierten Komplexsalz, das unterschiedliche Anionen enthält, können diese sowohl koordinativ als Liganden gebunden sein als auch als Gegenionen zum Komplexkation fungieren. Je nachdem, welche Anionen wie gebunden sind, liegen unterschiedliche Ionenisomere vor (Bild 7). Die Eigenschaften des Komplexes (z. B. Farbe) sind davon abhängig, welches der Ionen als Ligand gebunden ist. Das andere Ion liegt dissoziiert vom Komplex vor, wenn man die Kristalle in Wasser löst. Durch Fällungsreaktionen lässt sich untersuchen, welches der Ionen koordinativ gebunden ist.
-
Bei der Ionenisomerie fungieren die gleichen Anionen sowohl als Liganden als auch als Gegenionen.
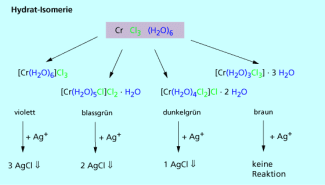
Die Hydratisomerie ist ein Spezialfall der Ionenisomerie. Bei dieser Form handelt es sich bei einem der beiden möglichen Liganden um Wasser.
Wasser kann aufgrund seiner freien Elektronenpaare auch als Ligand gebunden werden. Es kann also ebenfalls im Komplex koordinativ gebunden werden und so die Eigenschaften mitbestimmen. Ein Beispiel sind die verschiedenen Chrom-aqua-chloride, die sich z. B. in ihrer Farbigkeit unterscheiden (Bild 8).
-
Die Hydratisomerie ist eine Art der Ionenisomerie, bei der Wasser als Ligand beteiligt ist.
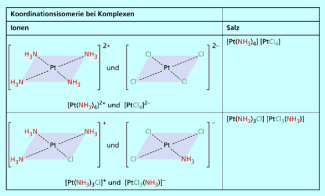
Koordinationsisomerie
Es gibt komplexe Salze, bei denen es sich sowohl beim Anion als auch beim Kation um eine Komplexion handelt. Ein Beispiel dafür ist Tetraamminplatin(II)-tetrachloroplatinat(II) .
Koordinationsisomere sind Salze, bei denen Kation und Anion Komplexe sind, die aber unterschiedliche Liganden (oder Ligandenkombinationen) gebunden haben (Bild 9).
Von dem erwähnten Platinsalz gibt es zwei verschiedene Isomere: Im ersten Fall haben beide Platin-Ionen vier gleiche Liganden. Im zweiten Fall ist ein Ligand ausgetauscht, man erhält Triamminmonochloroplatin(II) und Monoammintrichloroplatinat(II).
Werden zwei Liganden ausgetauscht, sind die entstehenden Teilchen elektrisch neutral, sie bilden also kein Salz.
Auch wenn die Zentralteilchen unterschiedlich sind, können Koordinationsisomere auftreten. Ein Beispiel hierfür sind die isomeren Komplexsalze Hexaammincobalt(III)-hexacyanochromat(III) und Hexaamminchrom(III)-hexacyanocobaltat(III) .
-
Die Koordinationsisomerie tritt bei Salzen auf, die aus Komplex-Anionen und Komplex-Kationen bestehen.