Räumlicher Bau von Komplexen
Die Anzahl der Liganden in einem Komplex wird Koordinationszahl (KZ) genannt, sie bestimmt seinen räumlichen Aufbau. Am häufigsten sind oktaedrische (KZ = 6), tetraedrische (KZ = 4) und quadratisch-planare (KZ = 4) Komplexe. Sowohl die Art der Liganden als auch die Art des Zentralteilchens haben Einfluss auf den räumlichen Bau eines Komplexes. Wie die unterschiedlichen räumlichen Anordnungen zustande kommen, kann durch die Valenzbindungstheorie oder die Ligandenfeldtheorie beschrieben werden.
Wird Nickel(II)-nitrat in Wasser gelöst und anschließend Ammoniak zugegeben, bildet sich der tiefblaue Hexaamminnickel(II)-Komplex. Bei der Zugabe von Kaliumcyanid bildet sich das gelbe Tetracyanonickelat(II)-Ion. Bei der Untersuchung der stöchiometrischen Zusammensetzung der beiden Komplexe ergibt sich folgendes überraschende Ergebnis: Im Amminkomplex ist das Verhältnis zwischen Ligand und Zentralteilchen 6:1, im Cyanokomplex nur 4:1. Wie kommt dieser Unterschied zustande? Offenbar hat die Art des Liganden Einfluss auf die Koordinationszahl (KZ) des Komplexes. Untersuchungen der Strukturen der Komplexe durch Röntgenbeugung ergaben, dass es sich um zwei geometrisch völlig verschieden aufgebaute Verbindungen handelt. Der Hexaammin-Komplex ist oktaedrisch (KZ = 6), der Cyanokomplex hingegen quadratisch-planar (KZ = 4) gebaut.
Koordinationszahl und räumlicher Bau
Ein Komplex besteht aus einem Zentralion und unterschiedlich vielen Liganden, die über koordinative Bindungen an das Zentralion gebunden sind. Die Zahl der Liganden wird Koordinationszahl (KZ) genannt, sie beträgt 2, 4 oder 6, woraus sich unterschiedliche räumliche Anordnungen der Liganden um das Zentralion ergeben.
![]()
Sowohl die Art des Zentralions als auch die Art der Liganden beeinflussen den räumlichen Bau von Komplexen.
Nickel(II) als Zentralion kann z. B. je nach Ligand tetraedrisch, quadratisch-planar oder oktaedrisch koordiniert sein.
Einige Metallionen bevorzugen auch bestimmte Koordinationen. Cr(III), Co(III) und Pt(IV) beispielsweise sind in oktaedrischen Komplexen typische Zentralionen. Die einfach geladenen Kationen der Kupfergruppe, Cu(I), Ag(I), Au(I), bilden bevorzugt lineare Komplexe. Quadratisch-planare Komplexe werden hauptsächlich von Metallionen mit Konfiguration gebildet, also u. a. von Ni(II), Pd(II), Pt(II), Au(III), Rh(I).
Diese Vorzugskoordinationen können sich mit der Ladung des Metallions verändern, so zieht Co(III) die oktaedrische, Co(II) hingegen die tetraedrische Koordination vor.
In vielen Fällen lassen sich die Koordinationszahlen von Komplexen mit der 18-Elektronen-Regel erklären. Weil diese jedoch nicht für alle Komplexe gilt und nur Aussagen über die Koordinationszahlen ermöglicht, werden andere Theorien wie die Valence-Bond-Theorie und das Modell der Hybridisierung oder die Ligandenfeldtheorie herangezogen, um den räumlichen Bau von Komplexen zu erklären.
-
Hexaamminnickel(II)- und Tetracyanonickelat(II)-Komplex

Heinz Mahler, Berlin
18-Elektronen-Regel
Die Anzahl der an der Komplexbildung beteiligten Liganden und somit das Auftreten bestimmter Koordinationszahlen bei vielen Metallionen, insbesondere bei denen der 8. Nebengruppe, lässt sich durch die 18-Elektronen-Regel erklären.
Diese stellt eine Erweiterung der Oktettregel dar: Während die Elemente der zweiten Periode, die nur s- und p-Elektronen zur Verfügung haben, die Edelgaskonfiguration mit acht Elektronen in der äußersten Schale anstreben (Oktettregel), ist die Edelgaskonfiguration bei den Nebengruppenelementen dann erreicht, wenn zusätzlich zu den insgesamt acht s- und p-Elektronen zehn d-Elektronen vorhanden sind, alles in allem also 18 Elektronen.
Die Zahl der Liganden steht im Zusammenhang damit, ob die Edelgaskonfiguration erreicht wird.
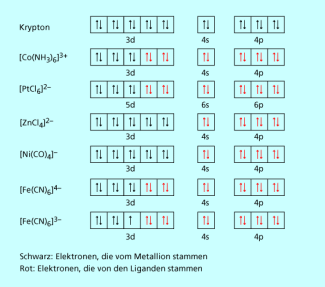
Die Komplexe beispielsweise erfüllen die 18-Elektronenregel, indem sie sechs Liganden binden, sie sind somit oktaedrisch koordiniert. Häufig reichen die Elektronen der Liganden aber nicht aus für das Erreichen der Edelgaskonfiguration, z. B. im Komplex , da das Eisen(III)-Ion eine ungerade Anzahl von Elektronen besitzt (Konfiguration). Demzufolge ist der Hexacyanoferrat(III)-Komplex instabiler als Hexacyanoferrat(II) und wirkt als Oxidationsmittel (Bild 2).
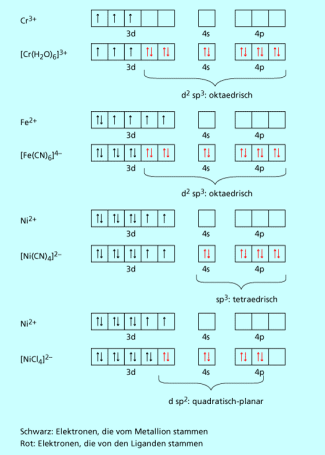
Weitere Beispiele für Komplexe, bei denen die 18-Elektronen-Regel nicht erfüllt ist, sind die anfangs erwähnten Nickel-Komplexe Hexaamminnickel(II) und Tetracyanonickelat(II) (Bild 1).
Valence-Bond-Theorie
Die chemische Bindung in Komplexen kann als Donor-Akzeptor-Wechselwirkung betrachtet werden. Die beiden Elektronen pro Bindungspaar stammen dabei immer vom Liganden, der als Lewis-Base wirkt. Das Zentralatom ist eine Lewis-Säure, welche ihre leere Orbitale für die Bindung zur Verfügung stellt. Durch Überlappung der Ligandenorbitale mit Orbitalen des Zentralions entstehen Bindungen, die ebenso wie kovalente Bindungen durch die Valence-Bond-Theorie beschrieben werden können. Da die Übergangsmetallionen unvollständig aufgefüllte d-Orbitale besitzen und auch die s- und p-Orbitale der nächsthöheren Schale für Bindungen zur Verfügung stellen können, kann ein Zentralteilchen mehrere Liganden binden. Mithilfe der Valence-Bond-Theorie und des Modells der Hybridisierung lassen sich die verschiedenen geometrischen Strukturen erklären.
-
Valenzbindungsdiagramme einiger Komplexe
Hybridisierung
Um zu erklären, weshalb die Bindungen in Komplexen gleichwertig sind, obwohl sie unter Beteiligung so unterschiedlicher Orbitale ausgebildet werden, nutzt man das Modell der Hybridisierung, d. h. der „Vermischung“ von verschiedenen Orbitalen zu einheitlichen Hybridorbitalen.
Je nach Art und Anzahl der an der Hybridisierung beteiligten Atomorbitale entstehen verschiedene Arten von Hybridorbitalen, die wiederum entscheiden, welche räumliche Struktur der Komplex annimmt (vgl. Bild 3).
Wichtige Hybridisierungstypen bei Komplexen:![]()
-
Valenzbindungsdiagramme weiterer Komplexe