Kugelpackungen
Metalle sind sich in ihren Eigenschaften sehr ähnlich, sie leiten beispielsweise alle den elektrischen Strom und sind verformbar.
Was die Anordnung der Metallatome im Metallgitter angeht, gibt es jedoch Unterschiede zwischen verschiedenen Metallen, d. h. die Metallatome sind in unterschiedlicher Weise räumlich angeordnet.
Man unterscheidet im Wesentlichen drei Gittertypen: Die hexagonal dichteste Kugelpackung, die kubisch dichteste Kugelpackung und die kubisch innenzentrierte Kugelpackung.
Kugelpackungen
Der Großteil der Elemente im Periodensystem sind Metalle, man findet sie in den Hauptgruppen links und eher unten, außerdem sind alle Nebengruppenelemente und die Lanthaniden und Actiniden Metalle.
Trotz dieser Vielfalt an Metallen weisen sie jedoch viele gemeinsame Eigenschaften auf:
| meist hohe Schmelz- und Siedepunkte, | |
| meist hohe Dichte, | |
| elektrische Leitfähigkeit, | |
| gute Deformierbarkeit (Duktilität). |
Die Eigenschaften der Metalle lassen sich anhand der Bindungsverhältnisse beschreiben.
Das Elektronengasmodell der metallischen Bindung
Beim Elektronengasmodell wird das Zustandekommen der Bindung folgendermaßen erklärt: Ein Teil der Metallatome gibt die Valenzelektronen, d. h. die auf der äußersten Schale befindlichen Elektronen, ab. So entstehen positiv geladene „Atomrümpfe“ und eine „Elektronengaswolke“ aus frei beweglichen Elektronen, die sich über den gesamten Festkörper erstreckt. Weil sich die negativ geladenen freien Elektronen des Elektronengases und die positiv geladenen Atomrümpfe gegenseitig anziehen, kommt es zum Zusammenhalt der Atome und somit zur Bindung (Bild 2).
Gitterstrukturen von Metallen
Alle Metalle außer Quecksilber sind bei Raumtemperatur fest, d. h. sie bilden Gitterstrukturen aus und die Metallatome befinden sich an festen Stellen innerhalb des Gitters.
Im Gegensatz zu Ionenverbindungen, bei denen eine Vielzahl unterschiedlicher Gittertypen bekannt sind, kommen bei den Metallen im Wesentlichen drei unterschiedliche Gitterstrukturen vor, die auch als Kugelpackungen bezeichnet werden. Je nach räumlicher Anordnung der Metallatome unterscheidet man die kubisch-innenzentrierte Kugelpackung, die kubisch-dichteste Kugelpackung und die hexagonal-dichteste Kugelpackung. Eine Theorie, die erklärt, weshalb Metalle in einer bestimmten Struktur auftreten und entsprechende Vorhersagen ermöglicht, gibt es bisher jedoch nicht.
-
Bindung in Metallen
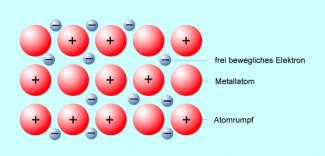
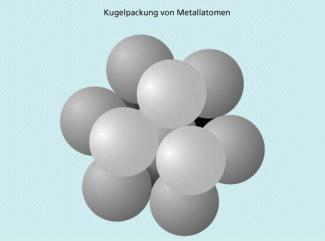
Die Bezeichnung „Kugelpackung“ kommt daher, dass die Metallatome im Gitter als Kugeln betrachtet werden, die einander berühren. Die Metallatome stoßen sich im Gegensatz zu den Ionen in Ionengittern gegenseitig nur wenig ab, da sie nicht geladen sind. Außerdem sind alle Atome eines Metalls gleich groß. Das führt dazu, dass in Metallgittern die hohen Koordinationszahlen (KZ) 8 und 12 möglich sind, d. h. dass jedes Metallatom von 8 bzw. 12 anderen Metallatomen umgeben ist.
Mehr als 12 Metallatome können allerdings nicht um ein Metallatom gepackt werden, wenn sich alle berühren sollen, sodass noch höhere Koordinationszahlen nicht erreicht werden können (Bild 3).
-
Um ein Metallatom passen maximal 12 gleiche Metallatome.
Die kubisch-innenzentrierte Kugelpackung
Bei der kubisch-innenzentrierten Kugelpackung ist jedes Atom würfelförmig (kubisch) von 8 Atomen umgeben, die Atome haben also die Koordinationszahl 8. Sie wird auch als kubisch-raumzentrierte Struktur bezeichnet.
Die Elementarzelle dieser Kugelpackung ist ein Würfel, bei dem Zentrum und Ecken von Atomen besetzt sind (Bild 4). In dieser Struktur liegen beispielsweise die Alkalimetalle, Vanadium, Chrom, Molybdän und Eisen vor.
Die kubisch-innenzentrierte Kugelpackung ist verwandt mit der Caesiumchloridstruktur, bei der jedes Ion würfelförmig von acht Ionen mit entgegengesetzter Ladung umgeben ist.
Dichteste Kugelpackungen
Bei den dichtesten Kugelpackungen lassen sich zwei Typen unterscheiden, die kubisch-dichteste und die hexagonal-dichteste Kugelpackung.
Bei beiden dichtesten Kugelpackungen ist die Koordinationszahl 12, d. h. jedes Atom ist von 12 weiteren Atomen umgeben.
Die Metallatome befinden sich in Schichten und sind dort möglichst dicht nebeneinander angeordnet:
Die verschiedenen Schichten werden so aufeinandergestapelt, dass sich die Atome der nächsten Schicht jeweils in den Lücken der darunter liegenden Schicht befinden:
Bis hierhin gibt es keinen Unterschied zwischen den beiden dichtesten Kugelpackungen, was die Anordnung der Atome angeht. Für die dritte Schicht ergeben sich jedoch zwei Möglichkeiten, weil es zwei Arten von Lücken gibt, auf denen die Atome der dritten Schicht liegen können:
Bei der hexagonal-dichtesten Kugelpackung liegen die Atome der dritten Schicht genau über denen der ersten Schicht (Bild 5). Da sozusagen Schicht A wiederholt wird, spricht man auch von einer Schichtenfolge ABAB. Beispiele für Metalle, die diese Struktur aufweisen, sind Magnesium, Titan, Cobalt und Zink.
Bei der kubisch-dichtesten Kugelpackung hingegen liegen die Atome der dritten Schicht nicht genau über denen der ersten Schicht, sondern über den gemeinsamen Lücken der ersten und zweiten Schicht. Erst die vierte Schicht ist deckungsgleich mit der ersten (Bild 6). Man bezeichnet die Schichtenfolge daher auch als ABCABC...
Doch weshalb wird diese Kugelpackung als kubisch bezeichnet? Verändert man den Blickwinkel auf ein solches Metallgitter, sodass die Ebenen nicht waagerecht, sondern schräg liegen, so erkennt man, dass die Elementarzelle dieser Gitterstruktur ein Würfel ist, dessen Ecken und Flächenmitten mit Atomen besetzt sind.
In dieser Struktur liegen wichtige Gebrauchsmetalle wie Aluminium, Blei, Kupfer, Silber und Gold vor.
Gitterstruktur und Eigenschaften
Die Gitterstruktur hat insbesondere Einfluss auf die plastische Verformbarkeit (Duktilität) von Metallen. Ein Metall lässt sich umso besser verformen, je mehr Gleitebenen innerhalb des Metalls vorhanden sind. Je mehr stabile Schichten es gibt, in denen die Metallatome gegeneinander verschiebbar sind, desto weicher ist ein Metall.
Die meisten Gleitebenen finden sich bei der kubisch-dichtesten Kugelpackung. Die entsprechenden Metalle, z. B. Blei, Kupfer, Silber und Gold sind daher verhältnismäßig weich und gut zu bearbeiten.
Viele Metalle mit kubisch-innenzentrierter Struktur sind hingegen vergleichsweise hart und spröde, so z. B. Chrom, Molybdän, Vanadium und Wolfram.
Eisen hat bei Raumtemperatur kubisch-innenzentrierte Struktur, wandelt sich aber bei 906 °C in mit kubisch-dichtester Struktur um. Letzteres ist deutlich leichter zu verarbeiten.
Legierungen bestehen aus zwei oder mehr unterschiedlichen Metallen. Im Gitter und somit innerhalb der Schichten sind also unterschiedliche Metallatome zu finden, wodurch die Gleitung der Schichten gegeneinander erschwert wird. Legierungen sind daher meist härter und spröder als die reinen Metalle, aus denen sie bestehen.

