Löslichkeitsgleichgewichte
Die Löslichkeit von Stoffen ist eine wichtige Größe in der analytischen und in der technischen Chemie. Sie entspricht der Konzentration eines Stoffes in einer gesättigten Lösung, die keine weiteren Teilchen des Feststoffes mehr aufnehmen kann. Die Löslichkeit hängt von verschiedenen Faktoren ab, der Art des gelösten Stoffs, dem Lösungsmittel, der Temperatur und dem pH-Wert der Lösung und eventuellen Zusätzen. So kann die Löslichkeit durch Zugabe von Säuren oder Komplexbildnern beeinflusst werden. In beiden Fällen liegt neben dem Löslichkeitsgleichgewicht ein weiteres chemisches Gleichgewicht vor und man spricht von gekoppelten Gleichgewichten.
Löslichkeitsgleichgewichte und Löslichkeitsprodukt
Gleichgewichtsreaktionen sind nicht nur bei technischen Synthesen von herausragender Bedeutung. Sie spielen, z. B. im Zusammenhang mit Säure-Base-Gleichgewichten oder Redoxgleichgewichten, auch in der Natur eine wichtige Rolle. Ein imposantes Beispiel für das Wirken von Löslichkeitsgleichgewichten in der Natur sind Tropfsteinhöhlen. Sie beruhen auf dem Carbonat-Hydrogencarbonat-Gleichgewicht.
Neben dem pH-Wert von Lösungen und den Redoxeigenschaften von Stoffen ist sowohl in der technischen als auch in der analytischen Chemie die Löslichkeit chemischer Verbindungen von Interesse.
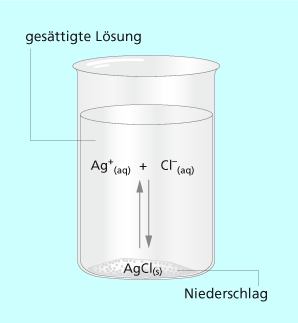
Gibt man zu einer Kochsalzlösung Silbernitratlösung, so fällt ein weißer Niederschlag von festem Silberchlorid aus. Man erhält eine gesättigte Silberchloridlösung mit Bodensatz (Bild 1). Obwohl nach Abschluss der Fällung keine Veränderungen zu beobachen sind, gehen dennoch ständig Silber- und Chlorid-Ionen in gleichem Maße in Lösung, wie sich wieder festes Silberchlorid erneut bildet. Die Ionen der gelösten Phase stehen mit dem Niederschlag in einem dynamischen Löslichkeitsgleichgewicht.
Wird Silberchlorid (AgCl) in Wasser gelöst, so müssen die Konzentrationen der gleich sein. Die Konzentration des Niederschlages hat keinen Einfluss auf die Gleichgewichtskonstante, da es sich um eine reine feste Phase handelt. Damit vereinfacht sich die Aussage des MWG zum Löslichkeitsgleichgewicht zu:
Die Konstante ist das Löslichkeitsprodukt von Silberchlorid. Die jeweils gleichen Konzentrationen an geben die maximale Löslichkeit L(AgCl) des Salzes in Wasser an. Bei weiterer Zugabe des festen Salzes würde sich kein weiteres Silberchlorid lösen, da konstant ist. Man nennt die über einem festen Niederschlag stehende Lösung daher eine gesättigte Lösung.
Die Kennzeichnung (aq) für hydratisierte Ionen wird der Übersichtlichkeit halber in den Gleichungen des MWG weggelassen. In Wasser gelöste Ionen sind immer hydratisiert.
Das Löslichkeitsprodukt eines Elektrolyten ist gleich dem Produkt der Konzentrationen seiner Ionen in einer gesättigten Lösung.
Für ein Salz der allgemeinen Zusammensetzung gilt:
Das Löslichkeitsprodukt darf nicht mit der Löslichkeit eines Stoffes verwechselt werden. Die Löslichkeit eines Salzes entspricht seiner Konzentration in einer gesättigten Lösung. Die Sättigung ist erreicht, wenn ein Bodenkörper des Feststoffs mit der darüber befindlichen Lösung im thermodynamischen Gleichgewicht steht. Zwischen den beiden Größen besteht folgender Zusammenhang:
Im einfachsten Fall, z. B. beim Silberchlorid, besteht das Salz aus gleichwertigen Ionen (x = y). Die Löslichkeit ist dann gleich der Wurzel des Löslichkeitsprodukts.
Löslichkeitsprodukt und Löslichkeit sind temperaturabhängig. Aus diesem Grund sind die tabellierten Werte von Löslichkeitsprodukten für bestimmte Temperaturen angegeben, in der Regel für 25 °C.
Die meisten Salze, z. B. Kaliumchlorid, lösen sich endotherm in Wasser, sodass ihre Löslichkeit mit steigender Temperatur zunimmt. Weit weniger Löslichkeitsgleichgewichte sind exotherm. Die Löslichkeit solcher Salze wie Calciumchromat sinkt mit steigender Temperatur.
Die Lösungsenthalpie ist die Differenz zwischen der Gitterenergie und der Hydratationsenthalpie, die bei der Bildung von hydratisisierten Ionen frei wird. Kochsalz hat eine sehr geringe Lösungsenthalpie, sodass die Löslichkeit von NaCl nahezu temperaturunabhängig ist.
Die Löslichkeit und das Löslichkeitsprodukt sind jedoch praktisch nicht druckabhängig, da die Volumenänderung während der Fällung vernachlässigbar ist. Im Gegensatz dazu kann die Löslichkeit von Stoffen durch Veränderungen der Konzentrationen beeinflusst werden.
Erhöht man die Konzentration der Chlorid-Ionen in einer gesättigten AgCl-Lösung durch Zusatz einer KCl-Lösung, so weicht das Gleichgewicht diesem Zwang aus. Unter Verbrauch der Chlorid-Ionen wird Silberchlorid ausgefällt und die – und damit die Löslichkeit des Salzes – sinkt. Der gleiche Effekt wird beobachtet, wenn man die Konzentration des anderen „Reaktionsprodukts“, der erhöht. In diesem Fall entspricht die Löslichkeit des Silberchlorids der .
Die Erhöhung der Konzentration einer Ionensorte durch gleichionige Zusätze führt zu einer Verringerung der Löslichkeit eines Salzes, weil das Löslichkeitsprodukt konstant bleibt.
Gekoppelte Gleichgewichte
Die Löslichkeit von Stoffen kann durch Zugabe von Säuren oder Komplexbildnern beeinflusst werden. In beiden Fällen liegt neben dem Löslichkeitsgleichgewicht ein weiteres chemisches Gleichgewicht vor und man spricht von gekoppelten Gleichgewichten.
Viele schwer lösliche Salze können durch Zugabe von Säuren oder Basen in Lösung gebracht werden. Die Ursache liegt darin, dass eine Ionensorte aus dem Löslichkeitsgleichgewicht gleichzeitig an einem Säure-Base-Gleichgewicht beteiligt ist.
Die schwer löslichen Sulfide sind die Salze der schwachen Säure Schwefelwasserstoff. Wenn man Eisensulfid durch Zugabe einer Säure auflösen will, liegen folgende Gleichgewichte vor.
Die Gleichgewichtskonstante der Protolyse der ergibt sich aus den beiden Säurekonstanten der zweiwertigen Säure
Durch Zugabe der Säure wird die im Säure-Base-Gleichgewicht erhöht und dadurch mehr Schwefelwasserstoff gebildet. Dazu werden dem Löslichkeitsgleichgewicht Sulfid-Ionen entzogen. Diese müssen durch Auflösen des Eisensulfids nachgebildet werden. Da Schwefelwasserstoff eine schwache Säure ist, liegt das Säure-Base-Gleichgewicht weit auf der Seite des Schwefelwasserstoffs und Eisensulfid wird bei hohen vollständig aufgelöst.
In der gleichen Weise kann die Löslichkeit eines schwer löslichen Salzes auch durch Zugabe von Komplexbildnern deutlich vergrößert werden. In diesem Fall wird ein Löslichkeitsgleichgewicht mit einem Komplexbildungsgleichgewicht gekoppelt.
Silberhalogenide sind in Ammoniak unterschiedlich löslich, da sich die Löslichkkeitsprodukte um mehrere Größenordnungen voneinander unterscheiden. Diese Tatsache macht man sich beim qualitativen Nachweis der Halogenid-Ionen zunutze.
So löst sich ein Niederschlag von Silberchlorid in Ammoniakwasser, wobei sich der lösliche Silberdiammin-Komplex bildet:
Dem Löslichkeitsgleichgewicht des Silberchlorids werden die durch die Komplexbildung entzogen. Diese werden durch Auflösen des festen Niederschlages nachgebildet, bis das der Niederschlag vollständig verschwunden oder das Löslichkeitsprodukt wieder erreicht ist. Während sich in einem Liter Wasser nur Silberchlorid lösen, sind in einem Liter einer 4 molaren Ammoniaklösung 0,16 mol des Salzes löslich.
Das Carbonat- Hydrogancarbonat-Gleichgewicht
Die Ausfällung von Calciumcarbonat ist ein Prozess im Zusammenhang mit der Wasserhärte.
Man unterteilt die Wasserhärte in zwei Arten, die temporäre Härte und die permanente Härte. Unter der temporären Härte versteht man den Gehalt an Calcium- und Magnesiumhydrogencarbonat im Wasser. Sie wird auch als Carbonathärte bezeichnet. In Abhängigkeit vom pH-Wert und der Temperatur des Wassers liegt ein Gleichgewicht zwischen Hydrogencarbonat-Ionen, Carbonat-Ionen und gelöstem CO vor. Es wird als Carbonat-Hydrogencarbonat-Gleichgewicht bezeichnet.
Bei Raumtemperatur und pH-Werten um den Neutralbereich liegt dieses Gleichgewicht auf der Seite des Hydrogencarbonats. Das Calcium- und das Magnesiumhydrogencarbonat sind leicht löslich.
Eine Erhöhung der Temperatur bewirkt, dass sich die Löslichkeit von CO im Wasser verringert und dieses aus dem Wasser entweicht. Dadurch wird das Gleichgewicht in der obigen Reaktionsgleichung nach rechts auf die Seite der Carbonat-Ionen verschoben. Die Zunahme der Carbonat-Ionen-Konzentration führt zum Ausfallen der schwerer löslichen Calcium- und Magnesiumcarbonate. Man kann dies gut beobachten, denn beim Abkochen von Wasser setzt sich Kesselstein ab. Durch das Ausfallen der schwerer löslichen Carbonate verringert sich die Härte des Wassers. Deshalb wird der Anteil der Wasserhärte, der durch die gelösten Hydrogencarbonate verursacht wird als temporäre Härte bezeichnet.
Das Carbonat-Hydrogencarbonat-Gleichgewicht spielt auch in der Natur eine wichtige Rolle.
Die Entstehung von Tropfsteinhöhlen
Betritt man eine Tropfsteinhöhle, ist man von der Formenvielfalt der Gebilde beeindruckt. Tropfsteine in den Höhlen entstanden durch sehr langsame Auflöse- und Ausfällungsprozesse von Kalkstein. Im Regenwasser wird Kohlenstoffdioxid aus der Luft gelöst. Dabei entsteht in geringem Maß Kohlensäure. Wenn das schwach saure Regenwasser durch porösen Kalkstein sickert, bildet sich leicht lösliches Calciumhydrogencarbonat.
Wenn dann aus dem an der Decke einer Höhle hängenden Tropfen das Wasser wieder verdunstet, bildet sich das schwer lösliche Calciumcarbonat zurück in Form der hängenden Stalaktiten. Verdunstet das Wasser an der Auftropfstelle am Boden, wachsen die Stalagmiten nach oben.