Mechanismus chemischer Reaktionen
Der Reaktionsmechanismus beschreibt den detaillierten Verlauf einer chemischen Reaktion in allen Teilschritten. Die Aufklärung des Reaktionsmechanismus umfasst die Analyse aller Elementarreaktionen, der Übergangszustände und der gebildeten Zwischenprodukte.
Die Aufklärung von Reaktionsmechanismen beginnt mit der experimentellen Bestimmung des Geschwindigkeitsgesetzes. Dazu überlegt man sich einen Reaktionsverlauf, der diesem empirischen Zeitgesetz gerecht wird. Wenn die Möglichkeit besteht, überprüft man diese Hypothese mit geeigneten analytischen Methoden.
Da die Zwischenprodukte und noch mehr die aktivierten Komplexe instabil und damit sehr kurzlebig sind, ist der analytische Nachweis jedoch oft schwierig. Er muss mit sehr schnellen, meist spektroskopischen Analysenmethoden geführt werden und erfordert einen hohen Aufwand.
Erst wenn man sämtliche Teilschritte, Zwischenprodukte und Übergangszustände aufgeklärt hat, kann Einfluss auf den geschwindigkeitsbestimmenden Schritt genommen werden, um so zielgerichtet die Geschwindigkeit der Gesamtreaktion zu verändern.
Die experimentelle Bestimmung der Geschwindigkeitsgesetze und die damit eng verbundene Aufklärung des Mechanismus chemischer Reaktionen sind die wichtigsten Aufgaben der chemischen Kinetik.
Relativ einfach ist diese Aufgabe bei den wenigen Reaktionen, bei denen die Elementarreaktion identisch mit der Bruttoreaktion ist, z. B. bei der nucleophilen Substitution 2. Ordnung oder bei einigen einfachen Gasreaktionen.
erfolgen anders als in einem einzigen Reaktionsschritt. Die Zahlen 1 und 2 stehen für die kinetische Ordnung der Reaktion. Reaktionen erster Ordnung bezeichnet man als monomolekulare Reaktionen. Reaktionen zweiter Ordnung sind bimolekular.
Bei monomolekularen Reaktionen hängt die Reaktionsgeschwindigkeit nur von der Konzentration eines Edukts ab, während bei bimolekularen Reaktionen die Konzentrationen beider Ausgangsstoffe einen Einfluß auf die Reaktionsgeschwindigkeit haben.
Die bimolekulare nucleophile Substitution
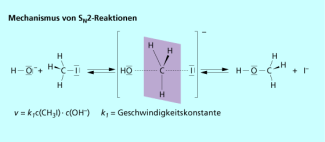
Bei der bimolekularen nucleophilen Substitution greift das nucleophile Reagenz von der „Rückseite“ des Tetraeders an und drängt den ehemaligen Substituenten heraus. Dabei gibt es einen „quasi fünfbindigen“ Übergangszustand. Bindungsspaltung und Bindungsneubildung laufen gleichzeitig ab. Die Kinetik der Reaktion ist zweiter Ordnung.
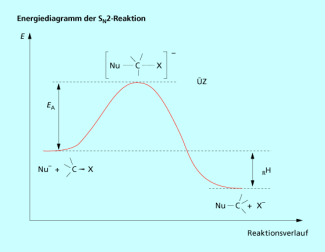
Das Energiediagramm der zeigt (Bild 2), dass während der Reaktion keine stabilen Zwischenstufen gebildet werden. Die Edukte durchlaufen einen reaktiven Übergangszustand (ÜZ) und bilden die Produkte.
-
Energiediagramm einer bimolekularen nucleophilen Substitution
Kinetische Untersuchungen zeigen eindeutig, dass die in einem einzigen Schritt abläuft. Deshalb gehen sowohl die Konzentration des Substrats als auch die Konzentration des Nucleophils in das Geschwindigkeitsgesetz ein (Bild 3).
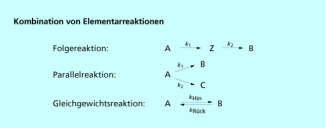
In den meisten Fällen durchlaufen die Reaktanten jedoch mehrere Schritte, die durch ein System von teilweise miteinander gekoppelten Geschwindigkeitsgleichungen beschrieben werden müssen. Grundsätzlich werden drei verschiedene Kombinationen von Elementarreaktionen bzw. kinetische Reaktionstypen beobachtet (Bild 4).
1. Folgereaktionen
Folgereaktionen beschreiben die stufenweise Reaktion von Ausgangsstoffen über ein oder mehrere Zwischenprodukte zu den Endstoffen.
Die Symbole A, Z und B können auch für mehrere Stoffe stehen.
| Beispiele für Folgereaktionen sind: | |
| 1. | Kettenreaktionen, z. B. bei Polymerisationsreaktionen oder bei der Bildung von HBr aus den Elementen, |
| 2. | - Reaktionen, Hydrolyse von Dicarbonsäureestern, Hydrolyse von tertiären Halogenalkanen oder |
| 3. | radioaktive Zerfallsreaktionen. |
-
Mechanismus einer bimolekularen nucleophilen Substitution
-
Kombination von Elementarreaktionen
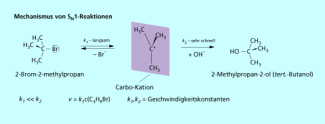
Die monomolekulare nucleophile Substitution
Anders als finden monomolekulare nucleophile Substitutionen in zwei Schritten statt. Zuerst erfolgt in einer Gleichgewichtsreaktion die heterolytische Spaltung der polarisierten Atombindung. Durch den Austritt der Abgangsgruppe als Anion wird ein Carbo-Kation gebildet.
Damit verbunden ist eine vorübergehende Änderung der Hybridisierung. Das Kohlenstoffatom im Substrat ist das Kohlenstoffatom im planaren Carbo-Kation ist
In einem zweiten Reaktionsschritt reagiert das nucleophile Reagenz mit dem Carbo-Kation zum Produkt. Der zweite Schritt läuft mit sehr hoher Geschwindigkeit ab. Die Bildungsgeschwindigkeit des Carbo-Kations ist im Vergleich dazu viel geringer.
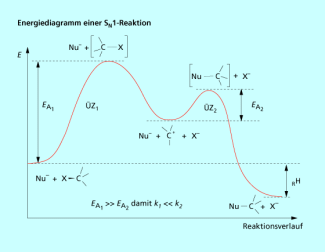
Das Energiediagramm der (Bild 6) zeigt die Bildung des Carbo-Kations als relativ stabile Zwischenstufe (Energieminimum). Außerdem erkennt man, dass die Aktivierungsenergie des ersten Überganszustands deutlich größer ist als die des zweiten.
Die Bruttoreaktion der monomolekularen nucleophilen Substitution ergibt sich aus der Summe der beiden Elementarreaktionen. In das Geschwindigkeitsgesetz geht jedoch nur die Geschwindigkeitskonstante der ersten Reaktion ein. Es handelt sich deshalb um eine Reaktion 1. Ordnung.
![]()
Die langsamste Elementarreaktion ist der geschwindigkeitsbestimmnede Schritt der Gesamtreaktion.
Je nachdem, wie das Verhältnis der Geschwindigkeitskonstanten der beiden Elementarreaktionen ist, ergeben sich unterschiedliche Geschwindigkeitsgesetze für Folgereaktionen.
| Unterschiedliche Fälle von Folgereaktion | ||
| – die 1. Teilreaktion bestimmt die Geschwindigkeit und das Zeitgesetz – das Zwischenprodukt wird sofort nach der Bildung verbraucht, sodass ist | – beide Teilreaktionen bestimmen die Geschwindigkeit der Gesamtreaktion über ein komplexes Zeitgesetz – typisch für radikalische Kettenreaktionen | – der 2. Teilschritt ist der geschwindigkeits-bestimmende Schritt – in kurzer Zeit wird viel Zwischenprodukt gebildet (c(Z) > 0), das analytisch relativ leicht nachweisbar ist |
2. Parallelreaktionen
Parallelreaktionen sind mehrere gleichzeitig nebeneinander verlaufende Reaktionen, die von gleichen Ausgangsstoffen zu verschiedenen Produkten führen. Der Anteil der Komponenten im erhaltenen Produktgemisch ergibt sich aus dem Verhältnis der Geschwindigkeitskonstanten der einzelnen Teilreaktionen.
-
Mechanismus einer monomolekularen nucleophilen Substitution
-
Energiediagramm einer monomolekularen nucleophilen Substitution
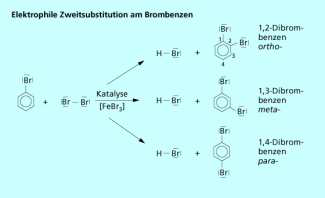
Die elektrophile Zweitsubstitution am Aromaten
Bei der Einführung eines zweiten Substituenten am Benzenkern können drei stellungsisomere Verbindungen entstehen. Das Beispiel zeigt die Einführung eines zweiten Bromatoms.
Die IUPAC-Nomenklatur bezeichnet die entsprechenden Stellungen durch arabische Ziffern. Gebräuchlich sind aber auch die Bezeichnungen ortho-, meta- oder para-Dibrombenzen.
Bei der Bromierung von Brombenzen erhält man ein Produktgemisch, das hauptsächlich aus ortho- und para-Dibrombenzen besteht. Die Bildung des meta-Produkts findet kaum statt, da das Bromatom als Substitut 1. Ordnung den elektrophilen Angriff in der ortho- und para-Position begünstigt. Die Produktverteilung ergibt sich aus dem Verhältnis der drei Geschwindigkeitskonstanten:
3. Gleichgewichtsreaktion
Gleichgewichtsreaktionen sind Reaktionen mit Hin- und Rückreaktion, die im Gleichgewichtszustand mit identischer Geschwindigkeit ablaufen.
Sind diese Reaktionen Teil eines Reaktionsmechanismus, dann wird der Gleichgewichtszustand jedoch nicht erreicht und es ergeben sich häufig komplexe Mechanismen der Gesamtreaktion.
-
Elektrophile Zweitsubstitution am Brombenzen