Merkmale und Einflussfaktoren auf das chemische Gleichgewicht
Ein chemisches Gleichgewicht kann sich nur bei einer umkehrbaren chemischen Reaktion im geschlossenen thermodynamischen System einstellen. Es kann durch Änderungen der Reaktionsbedingungen Temperatur, Druck oder Konzentration der Reaktanten auf unterschiedliche Weise beeinflusst werden.
Voraussetzungen
Ein chemisches Gleichgewicht kann sich nur bei einer umkehrbaren Reaktion in einem geschlossenen oder einem abgeschlossenen thermodynamischen System einstellen.
| Merkmale | |
| 1. | Eine Gleichgewichtsreaktion ist durch einen unvollständigen Stoffumsatz gekennzeichnet, d.h. Ausgangsstoffe und Reaktionsprodukte liegen nebeneinander vor. |
| 2. | Hin- und Rückreaktion verlaufen im Gleichgewichtszustand mit gleicher Geschwindigkeit. |
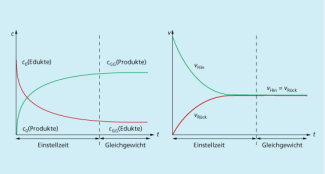
| 3. | Das Gleichgewicht ist ein dynamischer Zustand. Obwohl makroskopisch die Konzentrationen der Reaktanten konstant sind, erfolgt im mikroskopischen Bereich ein ständiger Stoffumsatz (Bild 2) |
| Einfluss der Reaktionsbedingungen | ||||||||||
Reaktionsbedingungen | Auswirkung | |||||||||
| Temperatur |
|
| ||||||||
| Druck |
|
| ||||||||
| Konzentration |
|
| ||||||||
Katalysatoren haben keinen Einfluss auf die Lage eines chemischen Gleichgewichts und auf die Ausbeute einer Reaktion. Sie beschleunigen nur die Einstellung des Gleichgewichts.
Die Gleichgewichtskonstante ist eine thermodynamische Größe, die sich aus den energetischen Unterschieden zwischen Ausgangsstoffen und Reaktionsprodukten ergibt. Sie kann quantitativ aus der freien Standardreaktionsenthalpie berechnet werden.
-
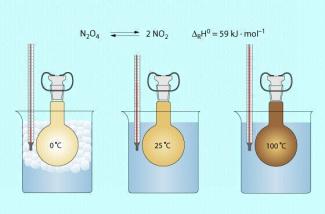
Die Reaktionstemperatur beeinflusst das Konzentrationsverhältnis der im Gleichgewicht liegenden Gase: farbloses Distickstofftetraoxid und dunkelbraunes Stickstoffdioxid.
-
Einstellung der Konzentration (links) und der Einstellzeit (rechts) des chemischen Gleichgewichtes.