Metallothermie – Verfahren zur Gewinnung von Metallen
Unter Metallothermie versteht man Verfahren, durch die bei hohen Temperaturen Metalle aus ihren Erzen hergestellt werden, wobei unedle Metalle als Reduktionsmittel eingesetzt werden.
Ein Beispiel für die Metallothermie ist die Aluminothermie, bei der Aluminium als Reduktionsmittel verwendet wird, um edlere Metalle wie Chrom aus ihren Oxiden oder Halogeniden zu gewinnen.
Dehnt man den Begriff Metallothermie auf alle Verfahren aus, bei denen mit hohen Temperaturen Metalle gewonnen werden, so lassen sich auch weitere Hochtemperaturverfahren dazuzählen. So kann man z. B. reines Titan durch Zersetzung von Titantetraiodid bei 1200 °C herstellen.
Zahlreiche Metalle werden mit dem Hochtemperaturverfahren Metallothermie hergestellt.
Diese Methode wurde 1894 von GOLDSCHMIDT eingeführt.
Grundlage dieses Prozesses ist die Reduktion von Metalloxiden oder Halogeniden durch unedle Metalle wie Aluminium, Erdalkali- oder Alkalimetalle, wobei diese zu den entsprechenden Oxiden oder Fluoriden reagieren und das edlere Metall reduziert wird. Die Bildung der Oxide oder Halogenide der unedlen Metalle ist stark exotherm, sodass Temperaturen von 2200 – 2500 °C erreicht werden.
Metallothermische Verfahren
Unter dem Begriff Metallothermie werden verschiedene Verfahren zusammengefasst, die alle nach demselben Prinzip funktionieren. Sie werden nach dem Metall, welches als Reduktionsmittel eingesetzt wird, benannt.
Beim Prozess der Aluminothermie werden z. B. Vanadium, Chrom oder Niobium gewonnen.
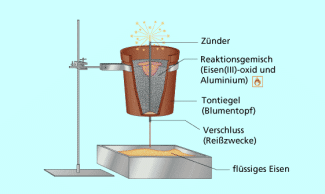
Eindrucksvoll ist als Demonstrationsversuch die Reduktion von Eisenoxid mit Aluminium in einem Tontopf (Blumentopf), bei der flüssiges Eisen gebildet wird (Bild 2).
Dieses Verfahren wird auch zum Thermitschweißen genutzt, um Schienen durch das flüssige Eisen miteinander zu verschweißen.
Die Magnesiothermie dient der Herstellung von Titan und Zirconium. Die Gewinnung von Titan nach diesem Verfahren wird Kroll-Verfahren genannt. Die Reaktion wird bei 850 °C unter einer Helium- oder Argonatmosphäre durchgeführt.
Die Calciothermie wird zur Herstellung von Seltenerdmetallen genutzt.
Vielfach wird bei den letzteren Verfahren, der Magnesio- und der Calciothermie, unter einer Schutzgasatmosphäre, d. h. unter Helium, Stickstoff oder Argon gearbeitet, da das entstehende Metall sonst bei den hohen Temperaturen sofort mit Sauerstoff reagieren würde.
Weitere Hochtemperaturverfahren zur Gewinnung von Metallen
Formal lassen sich auch andere Herstellungsmethoden für Metalle, die auf thermischen Prozessen beruhen, als metallothermische Verfahren einordnen. Manche Metalle lassen sich bei hohen Temperaturen durch thermische Zersetzung bestimmter Verbindungen gewinnen.
So werden beispielsweise beim van Arkel-de Boer-Verfahren Übergangsmetallhalogenide wie Titantetraiodid oder Zirconiumtetraiodid thermisch zersetzt, wobei das Metall in hoher Reinheit entsteht. Hierbei wird das pulverförmige, verunreinigte Metall zusammen mit etwas Iod in einem evakuierten Gefäß, in dem sich ein Glühdraht aus Wolfram befindet, zunächst auf 500 °C erhitzt. Das Tetraiodid, das dabei gebildet wird, verdampft und gelangt an den Wolframdraht, der eine Temperatur von 1200 °C hat. Dort zersetzt sich das Iodid, und reines Metall scheidet sich am Draht ab. Das frei werdende Iod reagiert nun mit weiterem verunreinigten Metall wieder zum Iodid.
-
Versuchsaufbau zum Thermitschweißen
Dieses Prinzip wird übrigens auch in Halogenlampen angewendet. Kleine Mengen von Iod, die in der Glühbirne sind, transportieren verdampfte Metallatome zurück an den Glühdraht und erhöhen dadurch dessen Lebensdauer. Außerdem ermöglicht der Rücktransport der Metallatome an den Draht eine höhere Glühfadentemperatur und somit ein helleres Licht.
Auch bei der Herstellung von Nickel mit dem Mond-Verfahren (Carbonyl-Verfahren) wird bei hohen Temperaturen gearbeitet. Als Ausgangsmaterial wird hier verunreinigtes Nickelmetall eingesetzt, das bei niedrigen Temperaturen mit Kohlenstoffmonooxid zu Nickeltetracarbonyl, einer Komplexverbindung, reagiert. Der entstandene Komplex wird anschließend bei höheren Temperaturen zersetzt, wobei reines Nickel und Kohlenstoffmonooxid entstehen.

