Nucleophile
Nucleophile sind Reagenzien, die über mindestens ein freies Elektronenpaar verfügen. Mit diesem Elektronenpaar greifen sie am Kohlenstoffatom an und verdrängen einen anderen Substituenten. Es gibt neutrale Nucleophile und anionische Nucleophile. Die Stärke eines Nucleophils wird als Nucleophilie bezeichnet und kennzeichnet die Reaktionsgeschwindigkeit mit einem Substrat. Die Nucleophilie ist stark vom Lösungsmittel abhängig.
Reagenzien werden nach ihren elektronischen Eigenschaften und der Art ihres Angriffs auf ein Substrat in zwei große Gruppen unterteilt – Nucleophile und Elektrophile. Als Nucleophile bezeichnet man Moleküle, die mit einem freien, ungebundenen Elektronenpaar an einem Substrat angreifen können. Der Name „Nucleophil“ bzw. die Eigenschaft „nucleophil“ kann mit „kernliebend“ übersetzt werden. Mit dem Wort „Kern“ ist aber hier das Kohlenstoffatom in einem Substrat gemeint, welches durch das Nucleophil angegriffen wird. Dieses anzugreifende Kohlenstoffatom hat aber noch Substituenten gebunden. Das Nucleophil muss also an diesen Substituenten „vorbei“ um an das Kohlenstoffatom zu kommen. Deshalb die Bezeichnung „kernliebend“, im Sinne von „an das Innere kommen“.
Typische nucleophile Reagenzien
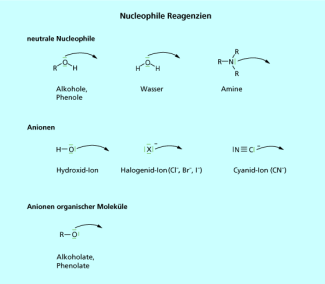
Entsprechend der Definition sind alle Moleküle, die über ein Sauerstoff- Stickstoff- oder Schwefelatom verfügen, potenzielle Nucleophile. Auch Anionen wie die Halogenide und das Alkoholat-Anion gehören in die Gruppe der nucleophilen Reagenzien (Bild 1).
Die Nucleophilie
Die Stärke von Nucleophilen (Nu) wird als Nucleophilie bezeichnet. Es ist eine kinetische Größe, die ausdrückt, wie schnell ein Nucleophil mit einem Substrat reagiert. Die Nucleophilie eines Reagenzes beinhaltet zwei Größen. Die erste ist die Energiefreisetzung infolge der C-Nu-Bindungsbildung. Die zweite Größe ist die Energieänderung durch die Änderung der Solvtisation, d.h. der Wechselwirkungen zwischen Nucleophil und Lösungsmittel.
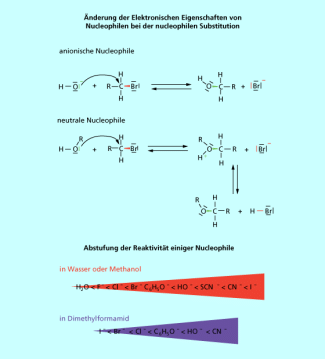
Die erste Größe muss nicht weiter erklärt werden. Die Energieänderung durch die Veränderung der Solvathülle ist komplizierter. Da für die Bindungsneubildung beide Bindungselektronen vom Reagenz geliefert werden, nimmt die Elektronendichte am Nucleophil ab. Neutrale Nucleophile werden durch die Bindungsbildung kationisch, anionische Nucleophile werden neutral. Dadurch ändert sich die Solvatation durch das Lösungsmittel drastisch (Bild 2).
-
Nucleophile Reagenzien
Lösungsmittelabhängigkeit
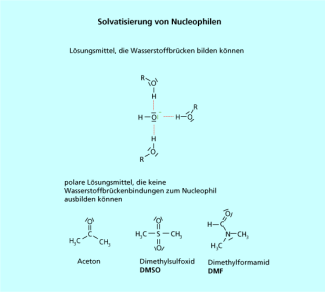
Die obigen Ausführungen zeigen, dass es eine absolute Abstufung der Nucleophilie von Reagenzien nicht geben kann. Es muss immer das Lösungsmittel berücksichtigt werden, in dem die Reaktion durchgeführt wird. Führt man die Reaktion in einem Alkohol durch, bilden sich sofort Wasserstoffbrückenbindungen zum freien Elektronenpaar des Nucleophils aus, das Nucleophil wird sehr stark solvatisiert. Das führt zu einer Abschwächung der Reaktivität des Nucleophils.
In Alkanen, die keine Wasserstoffbrückenbindungen ausbilden können, sind aber viele Nucleophile nicht löslich. Deshalb ist man auf polare Lösungsmittel angewiesen.
-
Da für die Bindungsneubildung beide Bindungselektronen vom Reagenz geliefert werden, nimmt die Elektronendichte am Nucleophil ab.
Für nucleophile Substitutionen werden deshalb häufig Aceton, Dimethylformamid (DMF), oder Dimethylsulfoxid (DMSO) benutzt. Sie sind polar, aber nicht in der Lage Wasserstoffbrücken zum Nucleophil auszubilden (Bild 3).
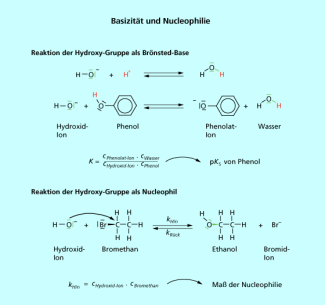
Basizität und Nucleophilie
Der Zusammenhang zwischen der Basizität und der Nucleophilie wird deutlich, wenn man bedenkt, dass sowohl in der nucleophilen Substitution als auch in einer BRÖNSTED-Säure-Base-Reaktion das Reagenz als Elektronendonator fungiert. Die Basizität ist eine thermodynamische Größe, die die Einstellung des Gleichgewichtes der Säure-Base-Reaktion widergibt.
-
Solvatisierung von Nucleophilen
Die Nucleophilie bestimmt aber die Reaktionsgeschwindigkeit, also eine kinetische Größe, des gleichen Reagenzes mit dem positivierten Kohlenstoffatom eines Substrates (Bild 4).
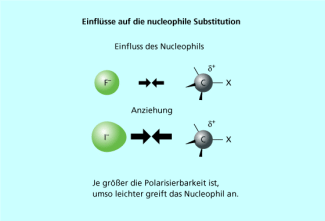
Die Nucleophilie hängt auch von der Polarisierbarkeit der Teilchen ab. Man kann nachweisen, dass hoch polarisierbare Nucleophile häufig reaktiver sind als Nucleophile gleicher Basizität, die aber nicht oder nur wenig polarisierbar sind. Unter der Polarisierbarkeit versteht man das Maß der Verschiebung einer Elektronenhülle in einem elektrischen Feld. Durch die Verschiebung der Elektronenhülle kann ein negativer Ladungsschwerpunkt im Nucleophil gebildet werden, was den Angriff auf das positivierte Kohlenstoffatom beschleunigt (Bild 5). Auf Grund der extrem hohen Polarisierbarkeit hat z. B. das Iodid-Ion auch in Methanol oder Wasser eine sehr hohe Nucleophilie. Eine nähere Erklärung findet man im Konzept der harten und weichen Säuren und Basen (HSAB-Konzept).
Nucleophile in chemischen Reaktionen
Die nucleophile Substitution ist eine Reaktion am Kohlenstoffatom, dass durch eine Abgangsgruppe partiell positiviert ist. Entsprechend der Kinetik kann die Reaktion nach einem oder einem Mechanismus ablaufen.
Alle Reaktionen am Kohlenstoffatom einer Carbonyl- oder einer Carboxy-Gruppe beginnen mit dem Angriff eines Nucleophils (einer nucleophilen Addition) auf dieses Kohlenstoffatom.
-
Basizität und Nucleophilie
-
Polarisierbarkeit des Nucleophils