Zweitsubstitution am Aromaten
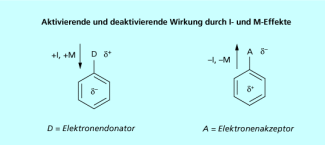
Substituenten am Aromaten mit einem –I- und/oder einem –M-Effekt erniedrigen die Elektronendichte im System. Das führt zu einer Deaktivierung des Aromaten, die Reaktivität sinkt. Umgekehrt aktivieren Substituenten mit einem +I- und/oder +M-Effekt den Aromaten. Damit steigt die Reaktivität. Außerdem haben die Substituenten einen dirigierenden Effekt, das heißt die Position der Zweitsubstitution wird durch den Erstsubstituenten bestimmt. Substituenten mit einem +I- und/oder einem +M-Effekt dirigieren in die ortho- oder para-Position, Substituenten mit einem –I und/oder einem –M-Effekt dirigieren ausschließlich in die meta-Position.
Die Wirkung der Erstsubstituenten auf das aromatische System.
1. Substituenten im Aromaten führen zur Erhöhung bzw. Erniedrigung der Elektronendichte in definierten Positionen.
Der -M-Effekt
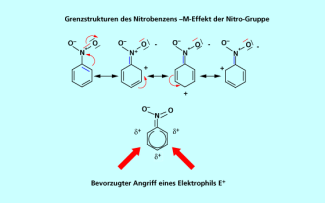
Der -M-Effekt eines Substituenten am Aromaten führt zu einer Verringerung der Elektronendichte . Die Grenzstrukturen im Beispiel Nitrobenzen (Bild 1) zeigen, dass dieser Elektronenabzug insbesondere in den beiden ortho- und der para-Position lokalisiert ist. Das heißt, wenn ein Elektrophil diesen elektronenarmen Aromaten angreift, dann in den meta-Positionen, da hier die Elektronendichte noch relativ am größten ist.
-
Der -M-Effekt der Nitro-Gruppe am Nitrobenzen
Der +M-Effekt
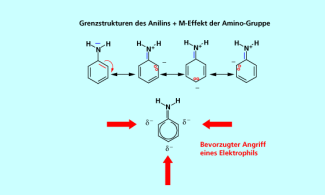
Der +M-Effekt eines Substituenten am Aromaten führt zu einer Erhöhung der Elektronendichte im System. Die Grenzstrukturen im Beispiel Anilin (Bild 2) zeigen, dass die Elektronendichte besonders stark in den ortho- und der para-Position erhöht wird. Demzufolge wird das Elektrophil bevorzugt in diesen Positionen angreifen und den Komplex bilden.
2. Die Erstsubstituenten haben eine stabilisierende oder destabilisierende Wirkung auf den Übergangszustand und auf den σ –Komplex
Induktive Effekte
Die induktiven Effekte der Erstsubstituenten wirken sich insbesondere auf die Stabilisierung oder Destabilisierung des Komplexes aus. Der Komplex ist einfach positiv geladen, da ein Elektron für die Bildung der neuen Bindung auf das Elektrophil übertragen wurde. Die positive Ladung wird im Ring über die verbleibenden fünf hybridisierten Kohlenstoffatome mesomeriestabilisiert.
-
Der +M-Effekt der Aminogruppe am Anilin
Der +I-Effekt
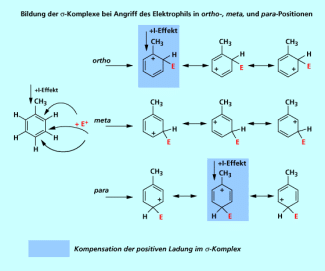
Die Bildung der Komplexe einschließlich der mesomeren Grenzstrukturen bei Angriff eines Elektrophils auf die ortho-, meta-, bzw. para-Position wird in Bild 3 gezeigt.
Man erkennt, dass es bei einem Angriff in ortho-, bzw. para-Position eine Grenzstruktur gibt, in der die positive Ladung im Sechsring direkt durch den +I-Effekt der Methyl-Gruppe stabilisiert werden kann. Diese beiden Strukturen haben eine deutlich höhere Stabilität als alle anderen. Bei Aromaten die als Erstsubstituenten eine Gruppe mit einem +I-Effekt tragen, wird also die Zweitsubstitution in ortho- und para-Position gefördert.
-
Aromaten mit einem Substituenten mit +I-Effekt
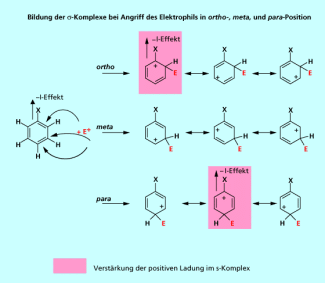
Der -I-Effekt
Es ist völlig klar, dass Substituenten mit einem -I-Effekt den positiv geladenen Komplex nie stabilisieren können. In Bild 4 erkennt man aber, dass es bei einem Angriff des Elektrophils in ortho- oder para-Position durch den -I-Effekt des Erstsubstituenten zu einer zusätzlichen Destabilisierung des Komplexes kommt. Deshalb dirigieren Substituenten mit einem -I-Effekt den Zweitsubstituenten in die meta-Position.
-
Aromaten mit einem Substituenten mit -I-Effekt
Mesomerie-Effekte
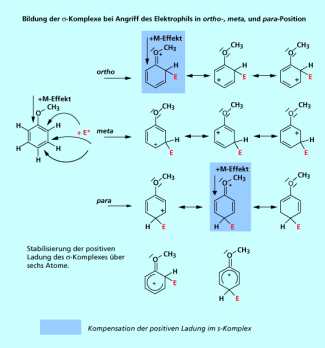
Mesomerie-Effekte werden im Bild 5 veranschaulicht. Es wird ein Beispiel gezeigt, bei dem ein Elektrophil das Elektronensextett des Anisols (Methylphenylether) angreift. Das Schema verdeutlicht, dass Substituenten mit einem +M-Effekt den Komplex zusätzlich stabilisieren können, wenn die Zweitsubstitution in ortho- oder para-Position erfolgt. Die Grenzstrukturen zeigen, dass die positive Ladung durch die Erweiterung des System jetzt über 6 Atome verteilt werden kann.
Ausnahme
Eine Ausnahme bilden die Halogenbenzene. Der -I-Effekt der Halogenatome ist größer als der +M-Effekt, was auch folgerichtig zu einer Deaktivierung des Aromaten führt. Nach den Darlegungen wäre zu erwarten, dass bei einer Zweitsubstitution die entsprechenden meta-Produkte gebildet werden. Das ist aber nicht der Fall. Elektrophile Substitutionen an Halogenbenzenen führen immer zu Gemischen von ortho- und para-Produkten. Die Ursache ist, dass im Übergangszustand und im Komplex der +M-Effekt der Halogenatome an Bedeutung gewinnt und den -I-Effekt überspielt.
Beispiel
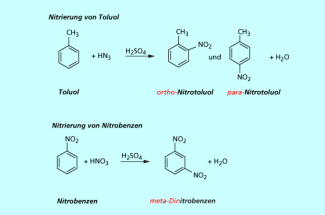
Es werden Toluen (Methylbenzen) und Nitrobenzen unter den gleichen Reaktionsbedingungen nitriert.
Es kann festgestellt werden:
- Die Nitrierung des Toluens läuft deutlich schneller ab als die Nitrierung des Nitrobenzens.
- Die Analyse der Reaktionsprodukte ergibt bei der Nitrierung des Toluens ein Gemisch aus ortho- und para-Nitrotoluen (1,2- und 1,4-Methylnitrobenzen).
- Im Gegensatz dazu erhält man bei der Nitrierung des Nitrobenzens ausschließlich meta-Dinitrobenzen (1,3-Dinitrobenzen).
- Beide Reaktionen sind elektrophile Substitutionen am Aromaten und
- der Erstsubstituent befindet sich nicht am Reaktionszentrum.
-
Der Mesomerie-Effekt
Daraus ergeben sich folgende Fragestellungen:
- Warum verlaufen die Reaktionen unterschiedlich schnell?
- Warum erhält man einmal ein Gemisch aus ortho- und para-Produkt und im anderen Fall ausschließlich das meta-Isomer?
1. Die unterschiedliche Geschwindigkeit
Da die Reaktionsbedingungen gleich sind, scheiden Temperatur und Konzentration als Ursache für die unterschiedlichen Reaktionsgeschwindigkeiten aus. Auch der Mechanismus ist in beiden Fällen gleich.
Entsprechend der ARRHENIUS-Gleichung:
muss also die Aktivierungsenergie bei beiden Reaktionen deutlich unterschiedlich sein. Die Aktivierungsenergie spielt eine entscheidende Rolle bei der Bildung des Komplexes, also bei der Ausbildung der Bindung zum Elektrophil.
Da die Erstsubstituenten nicht direkt am Reaktionsmechanismus beteiligt sind, müssen also elektronische Effekte dieser Substituenten, die sich auf das aromatische System auswirken, für die unterschiedlichen Reaktionsgeschwindigkeiten verantwortlich sein.
Substituenten mit einem +I-Effekt oder einem +M-Effekt erhöhen die Elektronendichte im Aromaten. Substituenten mit einem -I oder -M-Effekt ziehen Elektronendichte vom aromatischen System ab. Bei der greift das Elektrophil das System des Aromaten an und bildet eine s -Bindung auf Kosten der Elektronen aus. Dieser Angriff ist um so leichter, je höher die Elektronendichte im Aromaten ist. Das heißt also, die notwendige Aktivierungsenergie ist vergleichsweise gering, wenn sich Substituenten mit einem +I bzw. +M-Effekt am Aromaten befinden. Sie haben eine aktivierende Wirkung auf den Aromaten.
-
Die Nitrierung von Toluen und Nitrobenzen
Trägt ein Aromat schon einen Substituenten, der die Elektronendichte aus dem aromatischen System abzieht, ist dieser Aromat deutlich „unwilliger“ beim Angriff des Elektrophils Elektronen zur Verfügung zu stellen. Um diese Reaktion zu erzwingen braucht das System eine deutlich höhere Aktivierungsenergie. Substituenten mit einem -I- bzw. -M-Effekt haben demzufolge eine deaktivierende Wirkung auf den Aromaten.
Kommen wir zu unserem Beispiel zurück. Toluen trägt eine Methyl-Gruppe (+I-Effekt), das heißt wir haben einen aktivierten Aromaten, die Zweitsubstitution verläuft schnell.
Die Nitro-Gruppe im Nitrobenzen hat einen -I- und -M-Effekt. Wir haben also einen deaktivierten Aromaten, die Zweitsubstitution verläuft deutlich langsamer.
2. Die unterschiedlichen Stellungsisomere
Die zweite experimentelle Beobachtung war die Bildung der unterschiedlichen Stellungsisomeren bei der Zweitsubstitution. Auch dies wird durch die Erstsubstituenten gesteuert, man bezeichnet dies als dirigierende Wirkung.
Der +M-Effekt der Methyl-Gruppe am Toluen führt zu einer Erhöhung der Elektronendichte besonders in den ortho- und der para-Position im System. Demzufolge wird das Elektrophil bevorzugt in diesen Positionen angreifen und den Komplex bilden.
Andererseits führt der -M-Effekt der Nitro-Gruppe im Nitrobenzen zu einer Verringerung der Elektronendichte insbesondere in den beiden ortho- und der para-Position. D.h. ein Elektrophil greift in den meta-Positionen an, da hier die Elektronendichte noch am größten ist.
Zusammenfassend kann also gesagt werden:
Substituenten mit einem +I- und/oder +M-Effekt erhöhen die Elektronendichte im System. Das führt zu einer Aktivierung des Aromaten. Damit steigt die Reaktivität.
Aktivierend
+I-Effekt: Alle Alkylgruppen
+M > -I-Effekt: OH-Gruppe,
Umgekehrt deaktivieren Substituenten mit einem -I- und/oder einem -M-Effekt den Aromaten durch Erniedrigung der Elektronendichte im System. Die Reaktivität sinkt.
Deaktivierend
-I > +M-Effekt: Halogene
-I, -M-Effekt: CHO- und COR-Gruppe, COOH-Gruppe,
-
Aktivierende und deaktivierende Wirkung durch I- und M-Effekte.