Elektrophile Substitution
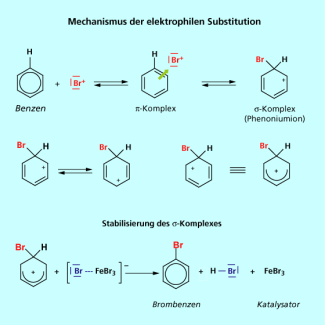
Die elektrophile Substitution am Aromaten führt zur Einführung einer neuen funktionellen Gruppe am aromatischen Ring. Sie verläuft über die Stufen Komplex, und Komplex. Bei der Reaktion wird das aromatische System durch die Ausbildung einer Bindung zum Elektrophil zerstört. Erst die abschließende Deprotonierung stellt den aromatischen Zustand wieder her.
Die elektrophile Substitution ist die typische Reaktion für Benzen (Bild 1) und andere Aromaten. Schon aus dem Namen der Reaktion kann man ableiten, es wird ein Wasserstoffatom des Benzens gegen eine neue Gruppe ausgetauscht und das Reagenz muss ein Elektrophil, also ein „Elektronen liebendes“ Molekül oder Atom sein.
Die elektrophilen Reagenzien werden meist in einer vorgelagerten Reaktion gebildet. Es sind entweder Kationen, Lewis-Säuren oder Komplexe mit Lewis-Säuren.
-
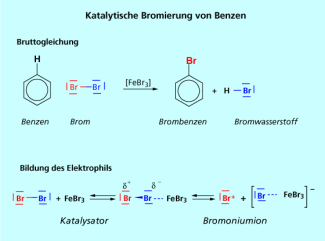
Katalytische Bromierung von Benzen
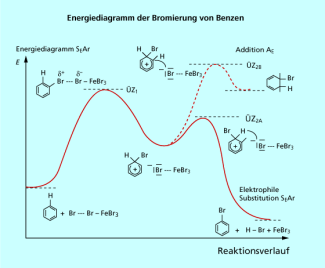
Das Energiediagramm der Bromierung von Benzen (Bild 2), eine typische elektrophile Substitution am Aromaten, zeigt, dass für die Ausbildung der Bindung zum Elektrophil im Komplex das aromatische System zerstört wird. Das heißt aber auch, dass im Reaktionsverlauf die Mesomerieenergie aufgebracht werden muss. Deshalb sind die Aromaten im Vergleich zu den Alkenen deutlich reaktionsträger. Aus der Abbildung erkennt man auch, dass nur die Abspaltung eines Protons und die Übernahme des ehemaligen Bindungselektronenpaars in das System den aromatischen Zustand wieder herstellen kann. Damit wird auch die Mesomerieenergie „zurückgewonnen“ und die Gesamtreaktion ist exotherm.
Als Konkurrenz zur muss die elektrophile Addition betrachtet werden. Auch sie beginnt mit dem Angriff des Elektrophils und der Ausbildung einer Bindung auf Kosten einer Bindung. Im zweiten Schritt der elektrophilen Addition lagert sich das Nucleophil, im Beispiel das Bromid-Ion am gebildeten Carbo-Kation an. Im Beispiel entsteht das 5,6-Dibromcyclohexa-1,3-dien. Diese Verbindung ist nicht aromatisch, das heißt, auf diesem Weg wird die Mesomerieenergie nicht zurückgewonnen. Die Reaktion ist endotherm. Deshalb findet bei der Umsetzung von Aromaten mit Elektrophilen keine Addition statt sondern fast ausschließlich die elektrophile Substitution.
1. Bromierung von Benzen - Synthese von Brombenzen
Die Bromierung von Benzen gelingt sehr gut, wenn man zu einer Suspension aus Benzen und einer katalytischen Menge von Eisenspänen elementares Brom tropft (Bild 1).
In einer vorgelagerten Reaktion setzt sich das Eisen mit dem elementaren Brom zu Eisen(III)-bromid um. Eisen(III)-bromid ist eine Lewis-Säure, da das Eisen eine Elektronenlücke hat. Deshalb bildet das Eisen(III)-bromid einem Komplex mit dem molekularen Brom. Durch die Komplexbildung kommt es zu einer Polarisierung der Brom-Brom-Atombindung, da das Eisen-Atom ein Elektronenpaar des Brom-Moleküls angreift. Dies führt zu einer Bindungspolarisierung der Atombindung im Brom-Molekül. Ein Brom-Atom wird dabei partiell positiviert. Vergleicht man die notwendige Energie für eine heterolytische Spaltung der Halogen-Halogen-Bindungen, stellt man fest, dass diese für das Brom-Molekül deutlich geringer ist als für Chlor oder Fluor. Man geht tatsächlich davon aus, dass die Brom-Brom-Bindung heterolytisch gespalten wird. Dabei bildet sich ein Kation (das Bromonium-Ion) und ein Anion (das Eisentetrabromid-Ion). Das Bromonium-Ion wirkt als Elektrophil und greift das System des Benzens an.
-
Energiediagramm der Bromierung von Benzen
Im Folgenden werden die typischen Schritte einer elektrophilen Substitution am Aromaten (Bild 3) durchlaufen. Es bilden sich der Komplex. Das ist eine Annäherung des positiv geladenen Elektrophils an das Elektronen-System, einem Ort mit sehr hoher Elektronendichte. Es folgt die Bildung des Komplex das heißt das Bromonium-Ion bildet eine Bindung mit einem Kohlenstoffatom des Aromaten aus. Die Elektronen dieser Bindung entstammen dem aromatischen Systems. Deshalb muss im s-Komplex der Sechsring eine positive Ladung tragen. Diese positive Ladung kann über die p-Orbitale der verbleibenden fünf Kohlenstoffatome delokalisiert werden. Das ist ein wichtiges Kriterium für die Stabilität des Komplexes, einer reaktiven Zwischenstufe mit einem Energie-Minimum. Die abschließende Deprotonierung führt zur Rearomatisierung und dem Produkt Brombenzen (Bild 4).
Das Proton reagiert mit dem Eisentetrabromid-Ion zu Bromwasserstoff, dem Nebenprodukt und Eisen(III)-bromid. In dieser Reaktion wird der Katalysator wieder regeneriert.
Brombenzen wird im technischen Maßstab synthetisiert und ist ein Zwischenprodukt für zahlreiche organische Synthesen. Insbesondere die Umsetzung mit metallorganischen Reagenzien führt zu einer weiteren Funktionalisierung des Benzenringes. Brombenzen wird als Lösungsmittel eingesetzt.
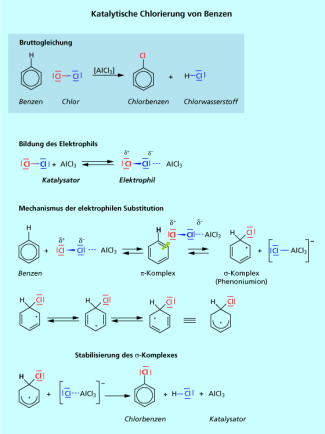
2. Chlorierung von Benzen - Synthese von Chlorbenzen
Der Mechanismus der Chlorierung (Bild 5) ist im Prinzip analog der Umsetzung von Benzen mit Brom. Der Unterschied ist die Bildung des Elektrophils. Bei der Chlorierung wird bevorzugt Aluminium(III)-chlorid als Katalysator eingesetzt. Die Verwendung von Eisen(III)-chlorid ist aber auch möglich. Der zweite Unterschied ist die Struktur des Elektrophils. Bei der Chlorierung von Aromaten kann man nicht von der Bildung eines Chlor-Kations ausgehen. Hier reagiert der gesamte Chlor-Aluminium(III)-chlorid-Komplex als elektrophiles Reagenz. Nach den für die elektrophile Substitution typischen Stufen Komplex - Komplex - Deprotonierung und damit Rearomatisierung wird das Chlorbenzen gebildet.
Chlorbenzen (Bild 6) wird als Lösungsmittel für Fette, Harze und Kautschuk eingesetzt. Es dient außerdem als Zwischenprodukt bei der Herstellung von Phenol, Pflanzenschutzmitteln, Farbstoffen, pharmazeutischen Produkten, Riechstoffen und Textilhilfsmitteln.
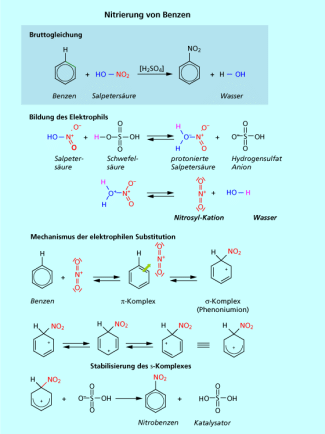
3. Nitrierung von Benzen - Synthese von Nitrobenzen
Konzentrierte Schwefelsäure wirkt stark „wasserentziehend“. Nitriersäure ist ein Gemisch aus konzentrierter Salpetersäure und konzentrierter Schwefelsäure. In der Nitriersäure stellen sich die drei Gleichgewichtsreaktionen ein, so dass das Nitronium-Ion als nitrierendes Reagenz gebildet werden kann.
Die Nitrierung von Benzen (Bild 7) beginnt mit der Bildung eines Komplexes. Das ist eine Annäherung des positiv geladenen Nitronium-Ions an den Ring, den die sechs freien Elektronen bilden - einem Ort hoher Elektronendichte.
Im nächsten Schritt bildet sich eine Atombindung zwischen einem Kohlenstoffatom des Benzringes mit dem Stickstoffatom des Nitronium-Ions. Dabei muss dieses Kohlenstoffatom in einen Hybridisierungszustand wechseln. Das Bindungselektronenpaar kommt aus dem Aromaten. Deshalb ist auch nach der Bindungsbildung eine positive Ladung im aromatischen System. Die positive Ladung kann über die 5 p-Orbitale der verbleibenden Kohlenstoffatome verteilt werden.
Den Abschluss der Reaktion bildet die Abspaltung des Protons am substituierten Kohlenstoffatom. Das ehemalige Bindungselektronenpaar zum Wasserstoffatom wird in das System aufgenommen. Das Kohlenstoffatom wechselt wieder in einen Hybridisierungszustand und das aromatische System ist wiederhergestellt. Als Produkt entsteht das Nitrobenzen .
Nitrobenzen (Bild 8) wird hauptsächlich zur Herstellung von Anilin und dessen Folgeprodukten verwendet. Es ist aber auch Zwischenprodukt für die Synthese von Sprengstoffen, Chlornitrobenzen, und Dinitrobenzen. Es wird als Lösungsmittel und als mildes Oxidationsmittel eingesetzt.
4. Sulfonierung von Benzen - Synthese von Benzensulfonsäure
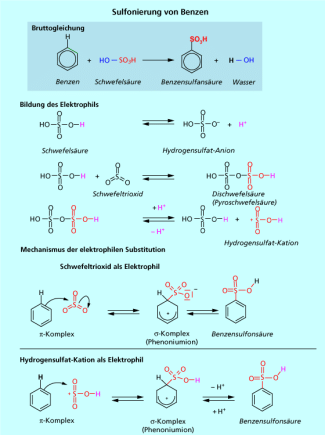
Die Reaktion von Aromaten mit konzentrierter Schwefelsäure oder mit Oleum (rauchende Schwefelsäure mit unterschiedlichem Schwefeltrioxid-Gehalt) führt in einer elektrophilen Substitution zur Einführung der Sulfonsäure-Gruppe in den Aromaten (Bild 9). Als Elektrophil agieren Schwefeltrioxid als Lewis-Säure oder das Hydrogensulfat-Kation Es wird in einem vorgelagerten Gleichgewicht gebildet. Im Schema ist die Reaktion mit Schwefeltrioxid formuliert. Sie verläuft über die typischen Zwischenstufen Komplex und Komplex. Als Besonderheit bei dieser Reaktion muss man darauf achten, dass der Komplex nach außen neutral ist. Durch die Bildung der s-Bindung zwischen einem Kohlenstoffatom des Aromaten und dem Schwefel wechselt ein Elektronenpaar aus der Bindung der S=O-Doppelbindung zum Sauerstoff und erzeugt hier eine negative Ladung. Das entspricht auch dem Gesetz der Ladungserhaltung, die Reaktion von zwei neutralen Molekülen (Benzen und Schwefeltrioxid) muss auch zu einem nach außen neutralem Produkt führen. Das im Folgeschritt aus dem Komplex abgespaltene Proton wird durch den negativ geladen Sauerstoff übernommen. Es bildet sich die Benzensulfonsäure .
Benzensulfonsäure dient als Katalysator für Dehydratisierungen, Veresterungen Polymerisations- und Polykondensationsreaktionen. Sie ist der Ausgangsstoff zur Herstellung von Benzensulfonsäurechlorid, einem wichtigem Reagenz im Labor.
-
Sulfonierung von Benzen
5. Alkylierung von Benzen - Synthese von Alkylbenzenen
Ist der Substituent am Benzenring der Rest eines Alkans, kommt man in die Stoffklasse der Alkylbenzene. Die Friedel-Crafts-Reaktion ist eine Möglichkeit Alkylbenzene zu synthetisieren.
Technisch werden in großer Menge Isopropylbenzen (Cumol) und Ethylbenzen hergestellt. In beiden Fällen erfolgt die Synthese aus Benzen und einem Alken (Propen bzw. Ethen) in Gegenwart von Schwefelsäure.
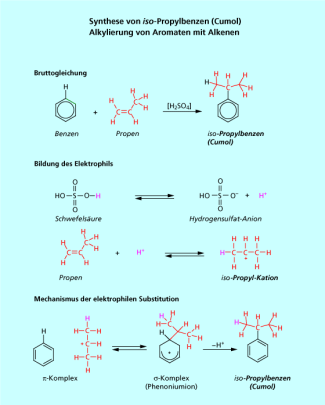
Synthese von Isopropylbenzen - Cumol-Synthese
Isopropylbenzen (Cumol) ist ein wichtiges Zwischenprodukt in der chemischen Industrie. Cumol ist der Ausgangsstoff für das Hock-Verfahren zur Synthese von Phenol und Aceton. Die Reaktion ist auch eine elektrophile Substitution am Aromaten (Bild 10). Das Elektrophil wird in einem vorgelagerten Gleichgewicht durch die Addition eines Protons an die Doppelbindung des Propens erzeugt. Entsprechend der MARKOWNIKOW-Regel addiert sich das Proton bevorzug am Kohlenstoffatom C-1 des Propen. Es entsteht eine Carbenium-Ion des Propans mit einer positiven Ladung am Kohlenstoffatom C-2. Diese Carbenium-Ion reagiert als Elektrophil und greift am Elektronensextett des Aromaten an. Es bildet sich wieder ein Komplex und danach ein Komplex. Die Deprotonierung und Rearomatisierung führt zum Produkt, dem Isopropylbenzen (Cumol, Bild 11).
Die Reaktion ist ein gutes Beispiel dafür, dass die Bruttoreaktion häufig nichts über den Reaktionsweg (Reaktionsmechanismus) aussagt. Bei flüchtigem Betrachten könnte man meinen, dass dies eine Addition ist . Eine genaue Untersuchung zeigt, dass im Reaktionsprodukt ein Proton der Schwefelsäure enthalten ist.
Cumol wird im großen Maßstab technisch für das Hock-Verfahren synthetisiert. Es wird auch als Zusatz für Flugzeugbenzine verwendet. In geringen Maße wird es den Kraftstoffen zur Erhöhung der Klopffestigkeit zugesetzt.
Nach dem gleichen Prinzip wird technisch aus Benzen und Ethen Ethylbenzen (Bild 12) hergestellt. Die katalytische Dehydrierung des Ethylbenzens führt zum Styren (Bild 13), dem monomeren Ausgangsstoff für die Polystyrensynthese.