Phosphor und Phosphorverbindungen
Phosphor als Element der V. Hauptgruppe tritt in mehreren Modifikationen auf. Da besonders der weiße Phosphor außerordentlich reaktionsfreudig ist und Phosphor mit Sauerstoff stabile polare Atombindungen eingeht, spielen vor allem die Sauerstoff-Verbindungen eine wichtige Rolle in Natur und Technik.
Phosphorsäure ist eine mittelstarke Säure und wird in der Getränkeindustrie als Konservierungsmittel eingesetzt. Der Hauptanteil dient jedoch der Herstellung verschiedener Phosphate.
Phosphorverbindungen sind im Organismus in der Knochensubstanz, in der DNA und im ATP enthalten und somit biologisch von großer Bedeutung. Daher sind Phosphate wichtige Nährstoffe für Pflanzen und müssen diesen als Düngemittel zugeführt werden. Daraus und aus der Anwendung als Komplexbildner in Waschmitteln ergibt sich das Umwelt schädigende Potenzial von Phosphaten. Der unkontrollierte Eintrag in Gewässer führt zu einem Massenwachstum an Algen und Wasserpflanzen und letztendlich zum Absterben aller Lebewesen in diesen Gewässern.
Phosphor ist ein Element der V. Hauptgruppe. Das Phosphoratom besitzt 15 Protonen und 16 Neutronen im Atomkern sowie 15 Elektronen in der Atomhülle. Davon befinden sich 10 Elektronen auf den beiden inneren, voll besetzten Elektronenschalen. Die restlichen 5 Elektronen auf der dritten, nicht vollständig besetzten Elektronenschale sind die Außenelektronen des Phosphors.
Um eine stabile Elektronenkonfiguration, die Edelgaskonfiguration des Argons, zu erreichen, kann Phosphor drei Elektronen aufnehmen. Mit einigen elektropositiven Metallen bildet Phosphor ionische Phosphide, die Phosphidanionen, , enthalten. Wesentlich häufiger jedoch geht Phosphor polare oder unpolare Atombindungen mit geeigneten Partnern ein. Anders als Stickstoff bildet Phosphor nur selten Mehrfachbindungen aus und kommt daher nicht als -Molekül vor. Wie alle Elemente der 3. Periode kann auch Phosphor mehr als 4 Atombindungen eingehen.
Phosphor wurde 1669 von dem Alchimisten Henning Brand (um 1630 - nach 1692) auf der Suche nach Gold bzw. dem „Stein der Weisen“ entdeckt, als er im eingedampften Harn unter Luftabschluss eine feste Substanz erhielt. Bei Lufteinwirkung leuchtete diese Substanz im Dunkeln und bekam deshalb den Namen (griech: phosphoros = Lichtträger, Licht tragend).
Modifikationen
Modifikationen sind verschiedene Erscheinungsformen ein und desselben Stoffes. Modifikationen eines Elements bestehen aus den gleichen Atomen, haben aber durch unterschiedliche Anordnung der Atome (Struktur) unterschiedliche physikalische und z. T. auch chemische Eigenschaften.
Vom elementaren Phosphor existieren mehrere Modifikationen, so z. B. weißer, roter, violetter oder schwarzer Phosphor. Die einzelnen Modifikation unterscheiden sich in ihren Strukturen und somit auch in ihren Eigenschaften.
-
Phosphor ist leicht entzündlich und deshalb Bestandteil in Köpfen von Streichhölzern.

Heinz Mahler, Berlin
Phosphoratome bilden untereinander keine Mehrfachbindungen. Um ein Elektronenoktett zu erhalten, werden bei der weißen Modifikation drei unpolare Atombindungen zu anderen Phosphoratomen und ein freies Elektronenpaar ausgebildet. Dadurch entstehen tetraederförmige -Moleküle, die aber im Gegensatz zu anderen tetraedrischen Strukturen (Kohlenstoff im Diamantgitter) energiereich sind (Bild 2). Aufgrund dieser Struktur ist weißer Phosphor außerordentlich reaktionsfreudig und entzündet sich selbst an Luft. Um zu verhindern, dass er mit dem Luftsauerstoff reagiert, muss weißer Phosphor unter Luftabschluss (z. B. unter Wasser) gelagert werden.
-
Tetraederstruktur des weißen Phosphors
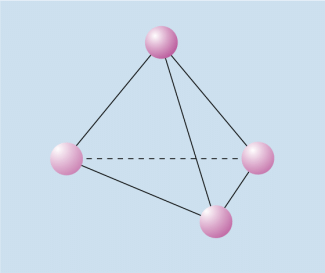
Weißer Phosphor ist kristallin, bei Zimmertemperatur wachsartig und löst sich nicht in Wasser. Er bildet sehr giftige Dämpfe und leuchtet im Dunkeln. Das Leuchten des weißen Phosphors im Dunkeln beruht darauf, dass er an der Luft in Spuren verdampft und langsam zu Phosphor(V)-oxid oxidiert wird. Bei dieser Reaktion wird Energie frei, die zum Teil als Licht abgegeben wird. Diese Erscheinung bezeichnet man als Phosphoreszens.
Roter, schwarzer und violetter Phosphor können aus der weißen Modifikation hergestellt werden. Sie bilden kompliziertere, dafür aber stabilere Strukturen (Bild 3).
Reaktionen des Phosphors
Das Element Phosphor ist ein typisches Nichtmetall. Es bildet in erster Linie polare Atombindungen zu anderen Partnern aus, die speziell bei den Phosphor-Sauerstoff-Verbindungen sehr stabil sind. In salzartigen Verbindungen ist Phosphor anionisch gebunden.
Der reaktionsfreudige weiße Phosphor ist schon bei tiefen Temperaturen selbstentzündlich. An trockener Luft verbrennt er zu Phosphor(V)-oxid, das aus -Molekülen aufgebaut ist.
Mit Halogenen, z. B. Chlor, reagiert Phosphor zu Halogeniden.
Phosphor kommt in der Natur nur in gebundener Form vor. Die wichtigsten Mineralien sind die Phosphate, z. B. Apatit
-
andere Modifikationen des Phosphors

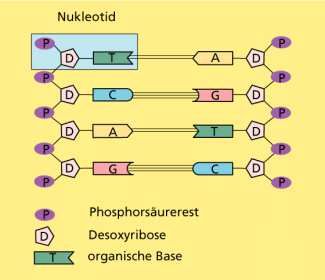
Hydroxylapatit, , bildet die Knochensubstanz bei Wirbeltieren. Auch sonst haben Phosphate große Bedeutung im Organismus. Sie sind u. a. in der DNA (Bild 4) und im Energieträger ATP (Adenosintriphosphat) enthalten.
Hergestellt wird elementarer Phosphor aus Calciumphosphat, das im Lichtbogenofen bei 1 400 °C mit Koks reduziert wird. Durch den Zusatz von Quarzsand wird das Calciumoxid in eine bei diesen Temperaturen dünnflüssige Schlacke aus Calciumsilicaten überführt.
Weißer Phosphor dient zur Gewinnung verschiedener Phosphorverbindungen, z. B. Phosphor(V)-oxid, Phosphorsäure und Phosphaten. Roter Phosphor wird zur Herstellung von Zündhölzern, Streichholzreibflächen, Feuerwerk und Brandbomben sowie zur Erzeugung künstlichen Nebels genutzt.
Phosphor-Sauerstoff-Verbindungen
Die Sauerstoff-Verbindungen des Phosphors sind verschiedene Oxide, deren Säuren und die Salze dieser Säuren.
Phosphor bildet Oxide unterschiedlicher Zusammensetzung, die wichtigsten Vertreter sind Tetraphosphorhexaoxid und Tetraphosphordecaoxid .
-
Phosphate sind Bestandteil der DNA.
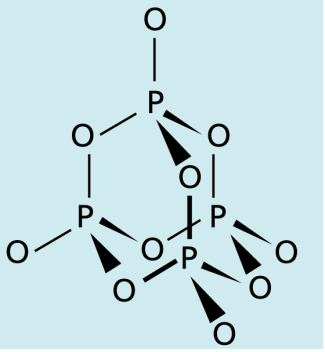
Technisch bedeutsam ist vor allem Phosphor(V)-oxid oder Tetraphosphordecaoxid, das nach dem stöchiometrischen Verhältnis der Elemente auch Phosphorpentoxid genannt wird, obwohl seine Summenformel ist. Die - Moleküle bilden eine sogenannte Käfigstruktur aus vier Phosphor- und zehn Sauerstoffatomen, die durch polare Atombindungen miteinander verbunden sind (Bild 5).
Phosphorpentoxid ist ein weißes geruchloses Pulver. Es reagiert sehr heftig mit Wasser unter Bildung von Phosphorsäure. Wegen der Wasser entziehenden Wirkung wird das Oxid als Trockenmittel verwendet.
Phosphor bildet eine Vielzahl von Säuren. Die wichtigste davon ist die Phosphorsäure . Phosphorsäure ist eine mittelstarke Säure, die drei Wasserstoff-Ionen (Protonen) abgeben kann und somit eine dreiprotonige (dreiwertige) Säure ist. Sie kann durch Umsetzung von Calciumphosphat mit verdünnter Schwefelsäure hergestellt werden:
Phosphorsäuremoleküle können durch Wasserabspaltung (Kondensation) miteinander verknüpft werden, wobei lineare oder verzweigte Ketten oder ringförmige Moleküle entstehen. Solche Kondensationsreaktionen spielen im Organismus eine wichtige Rolle, z. B. bei der Umwandlung von Adenosindiphosphat (ADP) zu Adenosintriphosphat (ATP), das als Energiespeicher dient. Die Kondensation von Phosphorsäure mit Hydroxy-Gruppen führt zu Phosphorsäureestern, die z. B. in der DNA (Bild 4) vorkommen und somit ebenfalls biologisch von großer Bedeutung sind.
Phosphorsäure dient als Ausgangsstoff für die Herstellung phosphathaltiger Düngemittel und von Wasserenthärtern auf Phosphatbasis. In der Getränkeindustrie wird sie als säuernder Zusatzstoff, z. B. in Cola, genutzt.
Bei der Neutralisation von Phosphorsäure entstehen Phosphate . Da Phosphorsäure eine dreiprotonige Säure ist, verläuft die Neutralisation über drei Stufen. Je nach den eingesetzten Mengenverhältnissen Phosphorsäure: Lauge erhält man Dihydrogenphospate (primäres Phosphat), Hydrogenphosphate (sekundäres Phosphat) oder Phosphate (tertiäres Phosphat). Da das dritte Proton nur schwer abgegeben wird (der pKs-Wert für die dritte Stufe der Phosphorsäure beträgt 12,3), kann man nur von starken Basen die tertiären Phosphate herstellen. Phosphate, vor allem Calcium- und Ammoniumphosphate, sind wichtige Düngemittel. Außerdem sind Phosphate als Komplexbildner in Waschmitteln enthalten.
-
schematische Darstellung der Käfigstruktur von Phosphorpentoxid
Aus beiden Anwendungen ergibt sich eine umweltschädigende Wirkung der Phosphate. Über Abschwemmung (Düngemittel) bzw. das Abwasser (Waschmittel) gelangen Phosphate in Flüsse und Seen. Dort fungiert Phosphat als Nährstoff für Wasserpflanzen und Algen. Durch das Überangebot an Phosphaten kommt es zu einem Massenwachstum der Algen. Wenn die abgestorbene Biomasse dann auf den Grund des Gewässers absinkt, wird dort sehr viel Sauerstoff für den Abbau verbraucht. Die Folge ist Sauerstoffmangel in den unteren Gewässerschichten, der letztendlich dazu führt, dass Fische und Wasserpflanzen absterben (Bild 6).
Aus diesem Grund gibt es in der BRD strenge Richtlinien zum Phosphateintrag in Gewässer. Moderne Waschmittel sind deshalb phosphatfrei oder zumindest phosphatarm.
Weitere Phosphor-Verbindungen
Phosphor bildet auch mit Halogenen und Wasserstoff Verbindungen unterschiedlicher Zusammensetzung - die Phosphorhalogenide und die Phosphane. Da jedoch die Phosphor-Sauerstoff-Bindung stabiler als die anderen Phosphor-Element-Bindungen ist, sind die Halogenide und Phosphane an Luft nicht sehr beständig. Sie sind daher im Alltag und in der Technik nur von untergeordneter Bedeutung.
Phosgen ist keine Verbindung des Phosphors, sondern nur der Trivialname für das giftige Gas . Der Name rührt daher, weil die Verbindung erstmalig von Sir M. DAVY bei Bestrahlung eines Gemisches von Kohlenstoffmonooxid und Chlor mit Licht (phosgen = mit Licht erzeugt) erhalten wurde.

