Redoxreaktionen als Donator-Akzeptor-Reaktionen
Redoxreaktionen sind Reaktionen, bei denen eine Elektronenübertragung stattfindet. Sie lassen sich in zwei Teilreaktionen zerlegen: Die Reduktion, die eine Elektronenaufnahme ist, und die Oxidation, bei der es sich um eine Elektronenabgabe handelt. Beide Teilschritte laufen immer gleichzeitig ab, und es werden ebenso viele Elektronen aufgenommen wie abgegeben.
Unter Redoxreaktionen versteht man chemische Reaktionen, bei denen Oxidationsvorgang und Reduktionsvorgang gleichzeitig ablaufen. Der Begriff Oxidation lässt sich auf ANTOINE DE LAVOISIER zurückführen und leitet sich vom lateinischen Namen für Sauerstoff, Oxygenium, ab. Den zur Oxidation umgekehrten Vorgang bezeichnet man als Reduktion (reducere: lat. = zurückführen).
Damit waren ursprünglich die Begriffe Oxidation und Reduktion an die Aufnahme und Abgabe von Sauerstoff gebunden. Diese Definition erwies sich jedoch als unzureichend, da man bald erkannte, dass viele Reaktionen einen ähnlichen Verlauf nehmen wie Verbrennungsprozesse, ohne dass Sauerstoff daran beteiligt ist.
Redoxreaktionen als Donator-Akzeptor-Reaktionen
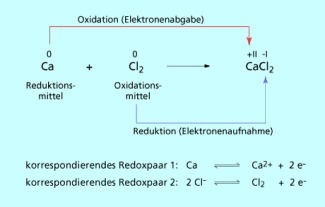
Beim Vergleich der Reaktionen von Metallen mit Sauerstoff und mit Halogenen erkennt man ein gemeinsames, wesentliches Merkmal: In beiden Fällen geben die Metalle Elektronen ab, die von den Reaktionspartnern aufgenommen werden.
Die Elektronenabgabe führt zur Oxidation des Metalls, während Sauerstoff bzw. Chlor diese Elektronen aufnehmen und in einer zweiten Teilreaktion reduziert werden. Da freie Elektronen äußerst reaktiv sind, erfolgen Oxidation und Reduktion gleichzeitig, d.h. die beiden Teilreaktionen sind miteinander gekoppelt. Es findet also eine Redoxreaktion statt. Bei Redoxprozessen werden keine Elektronen erzeugt oder vernichtet. Die Zahl der vom Calcium abgegebenen Elektronen ist gleich der Zahl der vom Sauerstoff bzw. Chlor aufgenommenen Elektronen.
Redoxreaktionen sind Elektronenübertragungsreaktionen , bei denen die Teilreaktionen Oxidation und Reduktion miteinander gekoppelt ablaufen. Die Oxidation erfolgt unter Elektronenabgabe, während die Elektronenaufnahme zur Reduktion führt.
Mit der Definition der Redoxreaktion als Elektronenübertragungsreaktion wird der Redoxbegriff, der ursprünglich nur für Reaktionen mit Beteiligung von Sauerstoff verwendet wurde, erweitert. Die erweiterte Definition bezieht sich nicht auf Stoffe, sondern auf bestimmte Atome in Verbindungen, die die Elektronen abgeben bzw. aufnehmen. Aus der damit verbundenen Änderung der Oxidationszahl dieser Atome erkennt man, dass es sich bei einer Reaktion um eine Redoxreaktion handelt.
Korrespondierende Redoxpaare
Da Chlor in der Redoxreaktion das Calcium oxidiert, wird es als Oxidationsmittel bezeichnet. Das Oxidationsmittel selbst wird während der Redoxreaktion reduziert und wirkt als Elektronenakzeptor.
Calcium hingegen reagiert als Reduktionsmittel, welches selbst Elektronen abgibt und deshalb Elektronendonator genannt wird.
Die oxidierte und die reduzierte Form von Teilchen, die durch Elektronenübertragung ineinander überführt werden können wie , bilden ein korrespondierendes Redoxpaar . An einer Redoxreaktion sind immer zwei korrespondierende Redoxpaare beteiligt, zwischen denen sich ein chemisches Gleichgewicht ausbildet.
Redoxreaktionen ähneln daher den Säure-Base-Reaktionen: Bei beiden Reaktionsarten werden Teilchen (Elektronen bzw. Protonen) zwischen den Reaktanten übertragen, und bei beiden stehen korrespondierende Paare (Redoxpaare bzw. Säure-Base-Paare) miteinander im Gleichgewicht.
-
Schema der Reaktion von Calcium mit Chlor