Rohstoffe zur Schwefelsäureherstellung
Zur Herstellung von Schwefelsäure wird Schwefeldioxid benötigt, das aus verschiedenen Rohstoffen gewonnen werden kann. Der wichtigste Rohstoff ist elementarer Schwefel, der im sogenannten FRASCH-Verfahren abgebaut wird oder bei der Entschwefelung von Erdöldestillaten erhalten wird. Weitere Ausgangsstoffe zur Gewinnung von Schwefeldioxid sind Erdgas, das Schwefelwasserstoff enthält, sulfidische Erze oder Calciumsulfat. In zunehmendem Maße wird auch verunreinigte Schwefelsäure, sogenannte Dünnsäure, recycelt und dient somit als Ausgangsstoff für die Schwefelsäureherstellung.
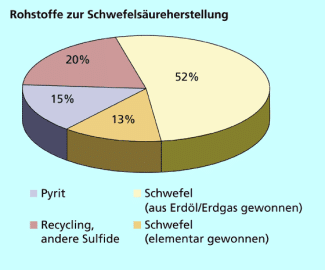
Das zur Herstellung von Schwefelsäure benötigte Schwefeldioxid kann aus verschiedenen Rohstoffen gewonnen werden.
Die wichtigste Quelle ist die Verbrennung von elementarem Schwefel, der natürlich vorkommt und jetzt auch in wachsendem Maße bei der Aufarbeitung von Erdöl anfällt, wenn die Erdölfraktionen entschwefelt werden.
Gewinnung von elementarem Schwefel (Frasch-Verfahren)
An der 16 km dicken Erdkruste hat Schwefel einen Anteil von 0,05 Gew.%. Damit belegt er in der Rangliste der häufigsten Elemente Platz 15.
Elementarer Schwefel kommt in zahlreichen Ländern einerseits in vulkanischen Lagerstätten (u. a. in Italien, Türkei, Japan), andererseits auch in Gestein eingeschlossen in einigen 100 m Tiefe vor (u. a. in USA, Russland, Polen). Letztere sind für die Schwefelgewinnung wirtschaftlich bedeutender.
Lagerstätten über einem Salzdom folgen einem typischen Aufbau: Über dem Salz befindet sich eine Schicht taubes Gestein, darüber liegt eine schwefelhaltige Formation, welche ebenfalls von taubem Gestein abgedeckt wird. Das schwefelhaltige Gestein enthält 20 - 40% Schwefel und ist mehrere 10 m dick. Für die Förderung mit dem FRASCH-Verfahren nutzt man den niedrigen Schmelzpunkt des Schwefels von 119°C aus.
In das Gestein werden drei konzentrische Rohre bis an das untere Ende der Gesteinsschicht gebracht. Durch das äußere Rohr, das am unteren Ende viele kleine Löcher hat, wird überhitztes Wasser von 160 - 170°C unter Druck in das Gestein gepresst.
Der Schwefel schmilzt im Nahbereich der Bohrung, sammelt sich am unteren Ende des Rohres und steigt durch den Wasserdruck im mittleren Rohr nach oben.
Durch das zentrale Rohr wird Luft gedrückt, die den geschmolzenen Schwefel durchmischt und an die Erdoberfläche fördert.
Eine Bohrung erlaubt die Schwefelgewinnung im Umkreis von 30 bis 40 m und liefert 30 000 bis 40 000 Tonnen Schwefel. Eine Lagerstätte wird dann durch mehrere benachbarte Bohrungen ausgebeutet. Der Aufwand an Prozesswasser und an Energie ist erheblich, pro Tonne Schwefel werden 10 - 15 Tonnen überhitztes Wasser gebraucht.
Der Schwefel kann dann in flüssiger Form über große Entfernungen per Pipeline, Schiff oder Eisenbahnwaggon transportiert werden.
Rösten von sulfidischen Erzen
Zahlreiche Buntmetalle kommen als sulfidische Erze vor, z. B. (Pyrit), ZnS (Zinkblende), PbS (Bleiglanz), (Kupferglanz), (Kupferkies) Diese sulfidischen Erze sind wichtige Rohstoffe für die Gewinnung der jeweiligen Metalle.
Zur Metallgewinnung werden die sulfidischen Erze zunächst geröstet, wobei das entsprechende Metalloxid und Schwefeldioxid entstehen.
Aus dem Metalloxid kann man dann - meist durch Reduktion mit Kohlenstoff (Koks) - das betreffende Metall gewinnen.
Das Schwefeldioxid, das als Nebenprodukt anfällt, wird dann zur Schwefelsäureherstellung genutzt. Im Vergleich zur -Gewinnung durch Schwefelverbrennung, wo ein sehr sauberes Gasgemisch anfällt, müssen die Röstgase sehr aufwändig gereinigt werden. Sie enthalten sehr viel Staub, außerdem können auch flüchtige Oxide anderer Elemente (z. B. Arsentrioxid , Selendioxid ) im Röstgas sein, da die entsprechenden Elemente häufig in geringen Mengen in den sulfidischen Erzen enthalten sind.
Diese zusätzliche Gasreinigung verteuert natürlich den Prozess. Da man aber die jeweiligen Metalle aus den sulfidischen Erzen gewinnen möchte, wird ein gewisser Teil der Schwefelsäure notwendigerweise auch weiterhin aus Röstgasen gewonnen, die Bedeutung dieser Quelle für die Schwefelsäureherstellung ist aber rückläufig.
Gips-Schwefelsäure-Prozess
Man kann auch aus dem in großen Mengen natürlich vorkommendem Calciumsulfat durch eine reduktive Spaltung Schwefeldioxid herstellen. Hierbei wird Calciumsulfat mit Kohlenstoff (Koks) umgesetzt, es entstehen Calciumoxid, Kohlenstoffmonooxid und Schwefeldioxid.
Durch Zusatz von Siliciumdioxid (Sand) und Aluminiumoxid (Tonmineralien) entsteht aus Calciumoxid als Koppelprodukt Zement.
Dieser Prozess wurde in der Vergangenheit durchgeführt, da er aber sehr energieaufwändig ist, wird er heute praktisch fast nicht mehr genutzt.
Schwefeldioxid aus Erdgas
Verschiedene Erdgaslagerstätten enthalten z. T. beträchtliche Anteile Schwefelwasserstoff, der aus verschiedenen Gründen aus dem Erdgas entfernt werden muss. Zum einen ist er toxisch und macht Katalysatoren in technischen Prozessen unwirksam. Zum anderen entstehen bei der Verbrennung von nicht entschwefeltem Erdgas beträchtliche Mengen an umweltschädlichem Schwefeldioxid.
Der durch einen speziellen Waschprozess abgetrennte Schwefelwasserstoff wird kontrolliert zu Schwefeldioxid verbrannt und dient als Rohstoff für die Schwefelsäureherstellung.
Im Zeitraum 2000 bis 2009 wurden in Deutschland jährlich jeweils 15 bis 20 Milliarden m³ Erdgas gefördert, was etwa 15-20 % des heimischen Bedarfs an Gas deckte. Daraus wurden jährlich jeweils ca. 1 Million Tonnen Schwefel als „Nebenprodukt“ gewonnen.
Entschwefelung von Erdölfraktionen
Die meisten Rohölsorten enthalten 0,3 bis 2 % organisch gebundenen Schwefel.
Durch gesetzliche Vorgaben werden die zulässigen Schwefelgehalte in den verschiedenen Siedefraktionen immer mehr begrenzt, um die Emission von umweltschädlichem Schwefeldioxid zu reduzieren.
In der Folge wurden die Anlagen zur Entschwefelung von Erdöldestillaten in Deutschland immer weiter ausgebaut.
Die Entschwefelung erfolgt in einem katalytischen Prozess. Unter Zusatz von Wasserstoff wird organisch gebundener Schwefel an einem Cobalt-Molybdän-Katalysator bei etwa 350°C und 3 MPa in Schwefelwasserstoff umgewandelt.
Schwefelwasserstoff wird aus dem Stoffgemisch durch Auswaschen mit einem Lösungsmittel abgetrennt und dann zu Schwefel oxidiert.
Schwefelwasserstoff kann auch - wie oben erwähnt - kontrolliert zu Schwefeldioxid verbrannt werden, das dann zur Schwefelsäureherstellung eingesetzt wird.
Recycling von Dünnsäure
Zunehmende Bedeutung gewinnt auch das Recycling von Schwefelsäure, die bei industriellen Prozessen, z. B. bei der Gewinnung von Titandioxid, verunreinigt wurde. Diese Säure wird wegen ihrer relativ niedrigen Konzentration von ca. 20 % Dünnsäure genannt.
Sie wird in einem komplizierten technischen Prozess wiederaufgearbeitet, wobei gemäß folgender Bruttoreaktion Schwefelsäure thermisch gespalten wird:
Das entstehende Schwefeldioxid wird bei der Schwefelsäuresynthese im Kontaktofen katalytisch zu reiner Schwefelsäure umgesetzt. Die Menge der zurück gewonnenen Schwefelsäure nimmt heute in Deutschland einen beträchtlichen Anteil an der Gesamtproduktion ein (Bild 4).
-
Rohstoffeinsatz Mitte der 90er-Jahre