Saure Gase und saurer Regen
Bei der Verbrennung fossiler Brennstoffe werden u. a. Schwefel- und Stickstoffoxide an die Atmosphäre abgegeben. Diese Gase sind als Smogbestandteile einerseits selbst schädlich für die Natur. Zum anderen bilden sie durch chemische Reaktionen in der Atmosphäre Säuren, die zu einer deutlichen Absenkung des pH-Werts des Regens führen.
Der saure Regen führt zu einer Versauerung der Gewässer und der Böden und schädigt langfristig die Vegetation. Auch Bauwerke unterliegen einer verstärkten Korrosion, da Metalle, Kalk und Beton durch die Säuren angegriffen werden.
Durch verschiedene Maßnahmen zur Verringerung der Emission stieg der pH-Wert des Regens in Deutschland seit 1990 wieder langsam an. Weltweit ist der Eintrag saurer Gase in die Atmosphäre jedoch nach wie vor extrem hoch.
Entstehung und Emission saurer Gase
Die fossilen Brennstoffe Erdöl und Kohle enthalten bis zu 2% organisch gebundenen Schwefel und Stickstoff, einige Erdölsorten sogar bis zu 7 % Schwefel. Bei der Verbrennung wird dieser Schwefel zu Schwefeldioxid oxidiert.
Bei hohen Temperaturen wird Stickstoff aus dem Brennstoff und aus der Luft hauptsächlich zum Stickstoffmonooxid (NO), daneben auch etwas zu Stickstoffdioxid oxidiert. Das Gemisch beider Stickstoffoxide bezeichnet man als Stickoxide, deren Bildung und Emission stark von der Verbrennungstemperatur abhängt. Daneben entstehen bei der Verbrennung noch große Mengen an Kohlenstoffoxiden .
Diese Gase bilden mit Wasser Säuren und werden deshalb als saure Gase bezeichnet.
Die größten Emissionen von stammten aus den Kraftwerken. Durch den Einsatz von Rauchgasentschwefelungsanlagen in den Kraftwerken konnten diese Emissionen seit den 70iger Jahren drastisch verringert werden.
Bei den -Emissionen waren Kraftwerke und der Verkehr Hauptverursacher. Die Emissionen der Kraftwerke wurden durch den Bau von sogenannten DENOX-Anlagen stark verringert. In diesen Anlagen werden die Stickstoffoxide mit Ammoniak zu ökologisch unbedenklichem Stickstoff reduziert. Die Freisetzung von Stickstoffoxiden im Straßenverkehr vermindern sich trotz Abgaskatalysatoren in Pkws nur wenig.
Emissionen saurer Gase in Gesamtdeutschland von 1970 bis 2007 in Mio. Tonnen
| Gas | 1970 | 1980 | 1990 | 2000 | 2005 | 2007 |
| CO2 | 1028 | 1127 | 1070 | 870 | 850 | 830 |
| SO2 | 7,7 | 7,5 | 5,3 | 0,63 | 0,51 | 0,49 |
| NOx als NO2 | 3,0 | 3,6 | 2,9 | 1,8 | 1,4 | 1,3 |
Wirkung saurer Gase in der Umwelt
Besonders gravierend sind die Auswirkungen des Schwefeldioxids und der Stickstoffoxide in der Atmosphäre.
Erhöhte -Konzentrationen in der Umwelt beeinträchtigen das Wachstum von Pflanzen und die Gesundheit von Menschen. Besonders drastisch waren die Auswirkungen 1952 in London, wo infolge hoher - und Staubgehalte in der Luft (sogenannter Smog) in wenigen Tagen rund 4 000 Menschen mehr als üblich starben.
Das Schwefeldioxid löst sich zudem im Wolkenwasser, es bildet sich schweflige Säure, die dann durch Luftsauerstoff zu Schwefelsäure oxidiert wird.
Auch das NO wird in der Luft zu oxidiert, welches dann mit Luftfeuchtigkeit unter Bildung von Salpetersäure regiert.
Die Säuren werden mit dem Regen ausgewaschen wodurch der pH-Wert des Niederschlags sinkt und man vom sauren Regen spricht.
„Sauberer“ Regen weist pH-Werte um 5,6 auf, ist also schwach sauer. Der natürliche Säuregehalt wird verursacht durch den Kohlenstoffdioxidgehalt der Luft. Auch löst sich in Wasser und reagiert teilweise zur schwachen Kohlensäure.
In Deutschland wurden in den 80er- und 90er-Jahren jedoch pH-Werte des Regens zwischen 4,0 und 4,5 gemessen, d. h. die 10- bis 40-fache Säurekonzentration im Vergleich zu „sauberen“ Regen. In Schottland traten sogar Spitzenwerte von pH = 2,4 auf, das entspricht der 1 000-fachen natürlichen Säurekonzentration!
Durch die hohen Schornsteine der Kraftwerke werden emittiertes und weiträumig verteilt. Sie können über mehr als 1 000 km vom Emissionsort entfernt dann als saurer Regen niedergehen. So versauerten in der Vergangenheit in Skandinavien viele Seen aufgrund der -Emissionen aus Westeuropa bei bevorzugter Südwest-Windströmung. In Schweden wurden so etwa 18 000 Seen, das sind ca. 20 % der Seen übersäuert, weil der pH-Wert unter 5,8 sank. Viele Fische reagieren empfindlich auf die Versauerung der Gewässer. Bereits bei pH-Werten unter 6 kommt es zu einem Rückgang der Fischpopulation und bei pH-Werten unter 5 können keine Fische mehr in den Gewässern leben.
-
Entstehung und Auswirkung des sauren Regens.
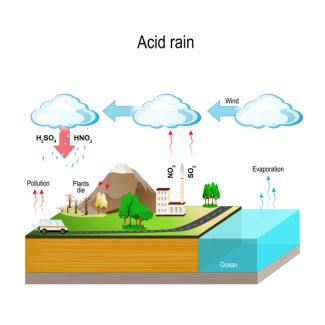
ttsz - iStock
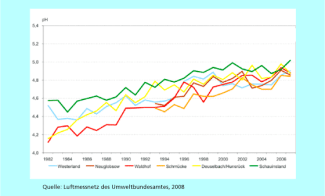
In Deutschland führte der Rückgang der - Emissionen nach der Einführung der Rauchgasentschwefelung in Kraftwerken wieder zu einem Anstieg des pH-Wertes in den Niederschlägen. In den 80iger und zu Beginn der 90er-Jahre lagen die pH-Werte zwischen 4,0 und 4,5. In den letzten Jahren liegen sie aber wieder im Bereich von pH 4,8 bis 5,0 (Bild 2), sind jedoch immer noch etwas niedriger als der pH-Wert von „sauberem Regen“ mit ca. 5,6.
Dabei hat sich aber der Anteil der verschiedenen Säuren verändert. Früher betrug das Verhältnis im Regen etwa 2,5 : 1, heute überwiegt mit etwa 1 : 1,5. Ursache ist in erster Linie der Verkehr, da die Stickstoffoxide aus Autoabgasen nicht vollständig durch Katalysatoren entfernt werden können.
-
Entwicklung des pH-Werts im Niederschlag an verschiedenen Messstationen in Deutschland
Auch die Vegetation wird durch die sauren Gase in der Luft und durch den sauren Regen langfristig geschädigt. Von besonderer Bedeutung sind die Schäden im Assimilationsgewebe, die die Fotosynthese beeinträchtigen (Bild 3). Es können aber auch Schäden an den Wurzeln auftreten, die dann zu Störungen in der Wasser- und Nährstoffaufnahme führen.
So führte der mehrere Jahrzehnte anhaltende Säureeintrag zu einer Versauerung des Bodens und damit zu einer Verschlechterung der Lebensbedingungen für die Baume. Durch die Säuren werden beispielsweise die kationischen Nährstoffe Calcium und Magnesium ausgewaschen.
Außerdem können giftige Stoffe freigesetzt, die wegen ihrer Unlöslichkeit für das Bodenleben normalerweise ohne Bedeutung sind. So wird Aluminium aus Tonmineralien durch die Säuren in wasserlösliche Salze überführt und von den Pflanzen aufgenommen. Dort stören die stören Aluminium-Ionen die Stoffwechselprozesse.
Erkennbar sind die Wirkungen des sauren Regens an Wuchsstörungen der Pflanzen, am Abwerfen von Nadeln bzw. Blättern, der Wipfeldürre und Kronenverlichtung und schließlich dem Tod der Pflanzen.
Neben dem sauren Regen wirken noch zahlreiche andere schädigende Einflüsse auf das Ökosystem Wald, so dass die Waldschäden eine sehr komplexes Ursachengeflecht haben und damit eine Therapie schwierig ist.
Auch an Bauwerken verursachen saure Gase und saurer Regen immense volkswirtschaftliche Schäden durch chemische Reaktionen. Kalk und sogar Beton werden durch die Säuren in unterschiedlichem Maße in lösliche Verbindungen überführt und vom Regenwasser weggespült. Die Bauwerke bzw. Kunstwerke verlieren zunächst ihre Konturen und später ihre Stabilität.
Auch Metallkonstruktionen unterliegen verstärkter Korrosion. Zunächst wird die Metalloberfläche oxidiert, sodass später sogar die Stabilität und Festigkeit von Bauwerken beeinträchtigt werden kann. Maßnahmen zum Korrosionsschutz (Farbanstriche, Galvanisieren etc.) oder die Verwendung korrosionsbeständiger Baustoffe verschlingen jährlich viele Millionen Euro.
Durch die Maßnahmen zur Verringerung der Emission saurer Gase sind die Umweltkonzentrationen von in Deutschland auch in früher hoch belasteten Gebieten praktisch auf das Niveau von Reinluftgebieten zurückgegangen. Bei sieht die Situation dagegen noch nicht so günstig aus.
Insgesamt sind aber die Säureeinträge in Mitteleuropa noch sehr hoch, und auch in den sich wirtschaftlich schnell entwickelnden Ländern wie Russland, China und Indien werden riesige Mengen an sauren Gasen an die Atmosphäre abgegeben.

