Struktur und Farbigkeit organischer Verbindungen
Die Farbigkeit einer organischen Verbindung hängt davon ab, wie viele delokalisiert sind. Je höher der Grad der Delokalisierung ist, desto farbiger erscheint uns eine Verbindung.
Wesentlichen Einfluss auf die Farbigkeit hat also die Struktur der Verbindung, d. h. die Zahl und Lage der Mehrfachbindungen und das Vorhandensein bestimmter funktioneller Gruppen. Weil das mesomere System durch den pH-Wert beeinflusst werden kann, hat auch dieser Einfluss auf die Farbigkeit. Außerdem kann das Lösemittel, in dem die Verbindung gelöst wird, mesomere Systeme stabilisieren bzw. destabilisieren und zeigt somit ebenfalls Einfluss auf die Farbe, die eine Verbindung hat.
Die Farbigkeit einer Verbindung ist abhängig vom Grad der Delokalisierung ihrer .
| 1. | Dieser wird von mehreren Faktoren beeinflusst, nämlich von der Struktur der Verbindung, insbesondere von Zahl und Lage der Mehrfachbindungen und von Substitution durch sogenannte chromophore Gruppen |
| 2. | vom pH-Wert, weil Protonierung bzw. Deprotonierung das mesomere System beeinflussen |
| 3. | vom Lösungsmittel, in dem eine Verbindung gelöst wird (Solvatochromie) |
1. Struktur der Verbindung
Durch Absorption elektromagnetischer Strahlung können Elektronen angeregt werden, sodass sie auf höhere Energieniveaus gelangen. Wird Licht aus dem sichtbaren Bereich absorbiert, erscheint eine Verbindung farbig. Welche Wellenlängen absorbiert werden, hängt von den Abständen der Energieniveaus und somit von der Struktur einer Verbindung ab.
Gesättigte organische Verbindungen sind farblos, da hier nur energiereiche stattfinden, deren Absorptionsbereich sich außerhalb des sichtbaren Bereichs im Ultravioletten Bereich (200 nm - 400 nm) befindet. Verbindungen, die über Mehrfachbindungen verfügen, absorbieren elektromagnetische Strahlung durch Übergänge der im längerwelligen Bereich. Dabei gilt, dass die Absorption desto weiter im sichtbaren Bereich liegt, je länger das System von konjugierten Doppelbindungen ist.
In Molekülen, die konjugierte Doppelbindungen enthalten, sind die delokalisiert. Das bedeutet, dass sie sich gleichmäßig über den gesamten konjugierten Bereich im Molekül verteilen und nicht einer bestimmten Bindung zugeordnet werden können. Man kann sie nur durch mesomere Grenzformeln korrekt darstellen.
![]()
-
Die Energiemengen, die für den Elektronenübergang in antibindende MOs nötig sind, und damit die Wellenlänge des absorbierten Lichts, hängen von der Art der beteiligten MOs, d. h. von der Struktur der Verbindung ab.

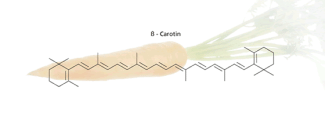
Diese delokalisierten „beweglichen“ Elektronen lassen sich besonders leicht anregen und absorbieren daher relativ energiearme Strahlung. So sind Polyene mit mehr als sieben Doppelbindungen farbig, wie z. B. das Strahlung im blau/violetten Spektralbereich absorbiert und daher gelborange erscheint (Bild 3).
Polymethine sind Polyene, die Methin-Gruppen enthalten und bei denen am Anfang und am Ende des mesomeren Systems aus konjugierten Doppelbindungen chromophore Gruppen stehen. Dies sind funktionelle Gruppen, die einerseits Heteroatome und andererseits freie Elektronenpaare oder Doppelbindungen enthalten und somit Elektronen liefern (Donatorgruppen mit +M-Effekt) oder Elektronen an sich ziehen (Akzeptorgruppen mit -M-Effekt).
Abhängig davon, welche Heteroatome in den chromophoren Gruppen vorhanden sind, werden Polymethine in Cyanine und Merocyanine unterteilt. Bei den Cyaninen befinden sich stickstoffhaltige Gruppen an Anfang und Ende des mesomeren Systems, bei den Merocyaninen eine stickstoffhaltige und eine sauerstoffhaltige Gruppe.
-
β-Carotin kommt z. B. in Mohrrüben vor.
-
β-Carotin kommt u. a. in der Mohrrübe vor.

infrontphoto - iStock
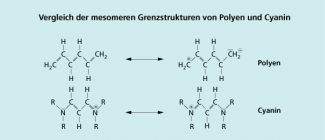
Im Gegensatz zu den Polyenen erscheinen Polymethine schon farbig, wenn sie mehr als drei konjugierte Doppelbindungen im Molekül besitzen. Die Ursache hierfür erkennt man bei einem Vergleich der mesomeren Grenzstrukturen (Bild 4).
Durch die Mesomerie entstehen in Polyenen immer Grenzformeln mit einer Ladungstrennung, d. h. im eigentlich ungeladenen Molekül treten eine negative und eine positive Ladung auf. Diese Grenzstrukturen sind im Vergleich zu den ungeladenen instabiler und werden ungern eingenommen. Es sind also nicht alle Grenzstrukturen gleichrangig und dadurch die nicht vollkommen delokalisiert.
Die in den Polymethinen enthaltenen chromophoren Gruppen verlängern nicht nur das mesomere System eines Moleküls, sondern stabilisieren es zusätzlich. Durch die freien Elektronenpaare können auftretende Ladungen gleichmäßig über das gesamte mesomere System verteilt werden, sodass alle Grenzstrukturen gleichrangig sind. Die sind daher stärker delokalisiert als bei den Polyenen und lassen sich leichter anregen.
Die Verschiebung des Absorptionsbereichs zu höheren Wellenlängen durch die Einführung von chromophoren Gruppe nennt man bathochrome Verschiebung.
Chromophore Gruppen sind:
Elektronenliefernde Gruppen nennt man Auxochrome, Elektronen ziehende Gruppen dagegen Antiauxochrome. Die Ladung ist am besten stabilisiert, wenn ein mesomeres System sowohl Donator- als auch Akzeptorgruppen enthält.
2. pH-Wert
Bei vielen Farbstoffen ändert sich die Farbigkeit in Abhängigkeit vom pH-Wert des Lösungsmittel. Durch Protonierung oder Deprotonierung des Moleküls ändert sich die Länge des mesomeren Systems und dadurch auch das Absorptionsmaximum der Verbindung. Wegen dieser Eigenschaft werden solche Farbstoffe als Säure-Base-Indikatoren eingesetzt.
-
Vergleich der mesomeren Grenzstrukturen von Polyen und Polymethin
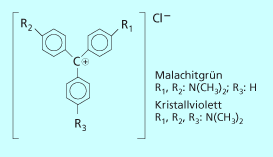
Ein Beispiel für eine solche Verbindung ist Kristallviolett (Bild 5). Unprotoniertes Kristallviolett absorbiert Licht im Bereich von 590 nm und ist violett gefärbt.
Durch die Protonierung eines Stickstoffatoms kommt es zu einem Farbwechsel nach grün, es hat also eine bathochrome Verschiebung stattgefunden, obwohl das mesomere System nicht verlängert wurde. Der Grund hierfür ist in der räumlichen Anordnung der Ringe zu sehen. Beim unprotonierten Kristallviolett sind alle Ringe gleichwertig. Aus Platzgründen stehen die Ringe verdreht zueinander, d. h. sie liegen nicht in einer Ebene. Bei der protonierten Form von Kristallviolett dreht sich der Ring, bei dem das Stickstoffatom protoniert ist, aus der Ebene heraus und steht senkrecht zu den beiden anderen. Dadurch haben diese genügend Platz, um planar in einer Ebene zu liegen, was die Mesomerie begünstigt.
Durch eine zweite Protonierung wird das mesomere System erheblich gekürzt, da die beiden Ringe mit den protonierten Stickstoffatomen sich nicht an der Mesomerie beteiligen. Die Verbindung ist nun gelb.
-
Strukturformeln von Malachitgrün und Kristallviolett
3. Solvatochromie
Als Solvatochromie bezeichnet man das Phänomen, dass bestimmte Substanzen in verschiedenen Lösungsmitteln eine unterschiedliche Farbe zeigen. Dies liegt daran, dass verschiedene Lösungsmittelmoleküle in unterschiedlicher Weise um die gelösten Moleküle angeordnet sind. Eine besondere Rolle spielen hierbei Dipol-Dipol-Wechselwirkungen. Die Wechselwirkungen zwischen den Farbstoffmolekülen und den Lösungsmittelmolekülen beeinflussen den energetischen Zustand der Farbstoffmoleküle und damit ihre Absorptionseigenschaften. So können beispielsweise bestimmte mesomere Grenzstrukturen von einem Lösungsmittel stabilisiert werden.
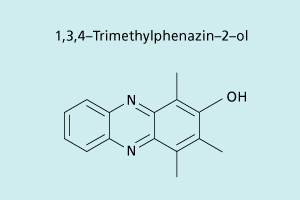
1,3,4-Trimethylphenazin -2-ol löst sich in konzentrierter Essigsäure (Eisessig) dunkelrot, in Ethanol rot, in Benzen gelb und in Essigsäureethylester hellgelb (Bild 6).
-
Strukturformel von 1,3,4-Trimethylphenazin-2-ol