Technische Herstellung von Ammoniak
Ammoniak ist eine der wichtigsten Chemikalien in der chemischen Industrie und dient als Ausgangsstoff für viele Synthesen.
Das technische Verfahren zur Ammoniaksynthese wird nach seinen Entwicklern Haber-Bosch-Verfahren genannt. Hierbei werden Wasserstoff und Stickstoff mithilfe eines Katalysators bei hoher Temperatur und hohem Druck zu Ammoniak umgesetzt. Die ablaufende Reaktion stellt ein Musterbeispiel für eine Gleichgewichtsreaktion dar.
Die Herstellung von anderen Stickstoffverbindungen erfolgt ausschließlich über Ammoniak. Weltweit werden jährlich über 100 Millionen Tonnen produziert, die zum Großteil zu Stickstoffdüngemitteln weiterverarbeitet werden.
Verwendung von Ammoniak
Ammoniak ist ein wichtiges Grundprodukt der chemischen Industrie, das als Ausgangstoff für viele chemische Synthesen dient. Etwa 80-85 % werden zur Herstellung verschiedener Düngemittel genutzt, der Rest wird u. a. zur Produktion verschiedener organischer Zwischenprodukte sowie von Kunststoffen und Synthesefasern eingesetzt.
Die technische Synthese von Ammoniak
Die technische Synthese von Ammoniak aus den Elementen Stickstoff und Wasserstoff beruht auf der Gleichgewichtsreaktion :
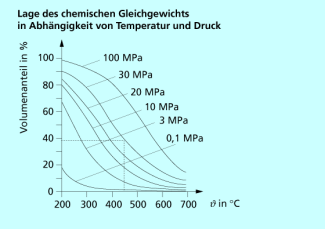
Die Bildung von Ammoniak aus den Elementen ist exotherm und verläuft unter Volumenabnahme. Nach dem Prinzip des kleinsten Zwanges begünstigen daher niedrige Temperaturen und hohe Drücke die Bildung von Ammoniak. Die Untersuchung des Gleichgewichtes ergab, dass es nur bei Temperaturen unter 200 °C und einem Druck von weit über 10 MPa weit gehend auf der Seite des Ammoniaks liegt (Bild 2). Bei diesen Temperaturen ist aber die Reaktionsgeschwindigkeit unmessbar klein, da insbesondere Stickstoff außerordentlich reaktionsträge ist.
Durch Einsatz eines Katalysators lässt sich die Einstellung des Gleichgewichts zwar beschleunigen, die technisch geeigneten Katalysatoren sind aber erst oberhalb 400 °C ausreichend wirksam.
Man arbeitet daher in der Technik bei 400 bis 520 °C und Drücken von 25 bis 30 MPa. Unter diesen Bedingungen verschiebt sich das Gleichgewicht wieder auf die Seite der Ausgangsstoffe, sodass man theoretisch einen Anteil von 35-40 % Ammoniak erzielen könnte. Da die Verweilzeit im Reaktor nicht zur vollständigen Gleichgewichtseinstellung ausreicht, beträgt der tatsächlich erreichte Umsatz bei einmaligem Durchgang durch den Reaktor jedoch nur 15 bis 20%.
Man trennt deshalb Ammoniak aus dem Reaktionsgasgemisch ab, indem man es durch Kühlung verflüssigt. Die nicht umgesetzten Ausgangsstoffe werden kontinuierlich wieder dem Reaktor zugeführt. Durch die Anwendung dieses Kreislaufprinzips können die Edukte vollständig umgesetzt werden (Bild 3).
-
Lage des chemischen Gleichgewichts in Abhängigkeit von Temperatur und Druck
Gewinnung der Ausgangsstoffe
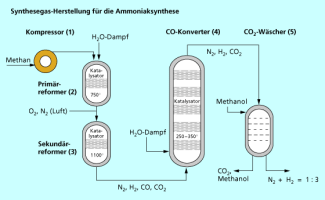
Die Ausgangsstoffe für die Ammoniaksynthese erhält man aus der katalytischen Umsetzung von Erdgas (Methan) mit Wasserdampf und Luft. Hierbei entsteht ein Gasgemisch aus Wasserstoff und Stickstoff im Verhältnis 3:1, das als Synthesegas eingesetzt wird. Der Einsatz von Methan ist hierbei günstiger als Kohle oder Erdölfraktionen, da für die Ammoniaksynthese Wasserstoff benötigt wird, der vom Methan schon mitgeliefert wird.
Mechanismus der Ammoniakbildung
Zur Beschleunigung der Reaktion der Edukte zum Ammoniak sind eine Reihe von Katalysatoren geeignet. In der ursprünglichen Versuchsanlage von FRITZ HABER wurde Osmium als Katalysator verwendet. Wichtig für den Erfolg des Verfahrens war jedoch die Entwicklung eines preiswerteren Katalysators hoher Lebensdauer durch ALWIN MITTASCH. Unter seiner Leitung wurden in über 20.000 Versuchen etwa 3.000 verschiedene Katalysatoren getestet. Als besonders geeignet erwies sich ein Kontakt aus metallischem Eisen, der durch Reduktion von Magnetit () entsteht und Zusätze von zur Aktivierung und Temperaturstabilisierung enthält.
-
Schematischer Ablauf der Synthesegasherstellung
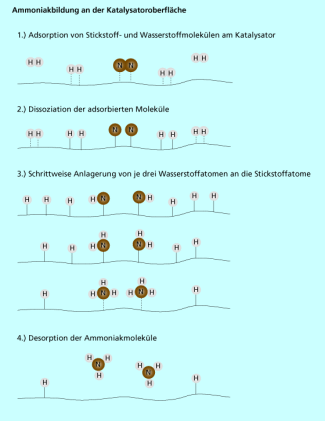
Der Mechanismus der Reaktion unter Beteiligung des Katalysators konnte erst im Jahre 1983 - Jahrzehnte nach Beginn der technischen Herstellung - endgültig aufgeklärt werden. Mit modernen spektroskopischen Methoden, die es gestatten, adsorbierte Teilchen an Katalysatoroberflächen näher zu charakterisieren, wurde von ERTL (der später den Nobelpreis erhielt) gezeigt, dass der entscheidende Schritt die Adsorption des Stickstoffs unter Dissoziation in Atome ist. In dieser Form ist der atomare Stickstoff viel reaktiver als der molekulare (Bild 4).
| Wasserstoff wird ebenfalls unter Dissoziation adsorbiert. |
| Der atomare Stickstoff reagiert dann in drei aufeinanderfolgenden Schritten mit adsorbiertem atomaren Wasserstoff zu Ammoniak. |
| Zum Schluss wird der adsorbierte Ammoniak in die Gasphase abgegeben. Diesen Vorgang nennt man Desorption. |
-
Mechanismus der Ammoniakbildung an der Katalysatoroberfläche
Die Grundlagen zur technischen Ammoniaksynthese aus Wasserstoff und Stickstoff entwickelte FRITZ HABER in den Jahren 1905 bis 1910 im Labor, die industrielle Umsetzung ist das Verdienst von CARL BOSCH. In der Badischen Anilin- und Sodafabrik (BASF) wurde schon 1913 die erste Anlage zur großtechnischen Ammoniaksynthese mit einer Tageskapazität von 30 Tonnen Ammoniak in Betrieb genommen. Eigens für die Ammoniaksynthese wurden die Leunawerke dann 1915 gebaut. Moderne Großanlagen erzeugen heute 1.000 -1.500 Tonnen Ammoniak pro Tag.

