Umkehrbarkeit chemischer Reaktionen
Eine grundlegende Eigenschaft chemischer Reaktionen ist ihre Umkehrbarkeit. Wird ein stöchiometrisches Gemisch aus Wasserstoff und Sauerstoff gezündet, so setzen sich die Ausgangsstoffe vollständig zu Wasser um.
Es ist aber auch möglich, durch Zufuhr elektrischer Arbeit Wasser wieder in die Elemente zu zerlegen. Chemisch lässt sich Wasser nur bei extrem hohen Temperaturen und niedrigen Drücken in die Elemente zerlegen. Viele andere Reaktionen sind jedoch auch unter normalen Bedingungen reversibel, d. h. die Hin- und die Rückreaktion laufen gleichzeitig und ungehemmt ab.
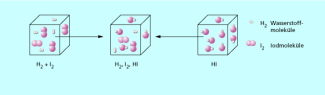
Setzt man in einem verschlossenen Kolben 1 mol Wasserstoff und 1 mol Iod bei 100 °C um, dann bildet sich Iodwasserstoff. Erhitzt man dagegen in einem anderen Kolben 2 mol Iodwasserstoff auf 100 °C, dann entstehen Iod und Wasserstoff. Die Analyse der Zusammensetzung der Gasgemische in beiden Kolben zeigt, dass sich absolut gleiche Konzentrationen an HI, I2 und H2 eingestellt haben. In beiden Fällen wird der gleiche Zustand erreicht, unabhängig davon, ob die Reaktion von links nach rechts oder von rechts nach links geführt wird.
Wird dieser Zustand von außen nicht weiter beeinflusst, z. B. durch Veränderung der Temperatur, bleiben die Konzentrationen der Reaktanten beliebig lange unverändert (Bild 1).
Es erfolgt nur ein unvollständiger Stoffumsatz , da die Hinreaktion und Rückreaktion gleichzeitig ablaufen. Gekennzeichnet wird diese Tatsache durch den Doppelpfeil in der Reaktionsgleichung. Die bereits gebildeten Reaktionsprodukte reagieren unter Rückbildung der Ausgangsstoffe, während gleichzeitig aus den Ausgangsstoffen neue Endprodukte entstehen. Es handelt sich um ein dynamisches Gleichgewicht.
Reaktionen, bei denen Hin- und Rückreaktion gleichzeitig und ungehemmt erfolgen, nennt man reversible Reaktionen . Reaktionen können nur dann reversibel ablaufen, wenn während der Umsetzung kein Reaktionspartner das System verlässt, also in einem geschlossenen System , das zwar Energieaustausch mit der Umgebung zulässt, jedoch keinen Stoffaustausch.
Auch Reaktionen, wie die Knallgasreaktion zwischen Wasserstoff und Sauerstoff, bei denen normalerweise ein vollständiger Stoffumsatz erfolgt, sind unter bestimmten Bedingungen umkehrbar.
Die Rückreaktion, die chemische Zersetzung von Wasser wird jedoch nur im geschlossenen System bei extrem hohen Temperaturen beobachtet. Beispielsweise liegen bei ca. 2 000 K 94 Vol.-% Wasser, 4 Vol.-% Wasserstoff und 2 Vol.-% Sauerstoff im Gasgemisch vor.
Man kann diese freiwillig ablaufende Umsetzung von Wasserstoff und Sauerstoff zu Wasser aber auch in einer Brennstoffzelle ablaufen lassen und gewinnt dabei elektrische Energie. Umgekehrt lässt sich Wasser durch Zufuhr elektrischer Energie wieder zu Sauerstoff und Wasserstoff zersetzen.. Wegen der Überspannungs-Effekte muss aber bei der Elektrolyse mehr Energie aufgewendet werden als in der Brennstoffzelle gewonnen wird.
Deshalb ist die Reaktion aus thermodynamischer Sicht unter normalen Bedingungen streng genommen nicht reversibel. Es lassen sich jedoch für fast alle Prozesse Bedingungen finden, unter denen sowohl die Hinreaktion als auch die Rückreaktion ablaufen.
-
Iod und Wasserstoff reagieren nicht vollständig zu Iodwasserstoff.