Verschiedene Batterietypen (Primärelemente)
Eine Stromquelle, die aus mehreren Monozellen besteht, nennt man elektrische Batterie. Batterien sind elektrische Quellen, in denen elektrische Energie gespeichert ist. Sie sorgen als Spannungsquellen für den Antrieb des elektrischen Stroms in Stromkreisen.
Monozellen und Batterien gibt es heute in verschiedenen Bauformen.
Zu den bekanntesten gehören die Zink-Kohle-Batterie und der Blei-Akkumulator, der als Autobatterie eine Rolle spielt.
Vom galvanischen Element zur Batterie
Galvanische Elemente sind nach dem italienischen Mediziner LUIGI GALVANI benannt. Sie bestehen aus zwei miteinander verbundenen aber räumlich getrennten elektrochemischen Halbzellen, in denen jeweils eine Elektrode in einen Elektrolyten eintaucht. Sie dienen der netzunabhängigen Stromversorgung, wobei an den Elektroden Redoxprozesse ablaufen. Es wird dabei chemische Energie in elektrische umgewandelt wird, die über einen äußeren Stromkreis nutzbar ist, da Oxidation und Reduktion räumlich getrennt ablaufen.
An der Katode findet dabei eine Reduktion statt. Es werden Elektronen von der Elektrode an ein Teilchen in der Lösung abgegeben. Die Anode nimmt Elektronen von einem gelösten Teilchen auf, das damit oxidiert wird. Zu den galvanischen Elementen gehören Batterien, Akkumulatoren und Brennstoffzellen.
In Batterien, die auch als Primärelemente bezeichnet werden, laufen diese Reaktionen an den Elektroden irreversibel ab, bei Stromentnahme werden die Stoffe verbraucht. Primärelemente kann man daher nicht wieder aufladen. Außerdem wird durch die Umwandlung von Anoden- oder Katodenmaterial bei der elektrochemischen Reaktion oft der konstruktive Aufbau der Zelle ungünstig beeinflusst. Ihre Lebensdauer ist damit begrenzt.
-
Verschiedene Batterietypen

MEV Verlag, Augsburg
-
Spannungen zwischen Halbzellen.
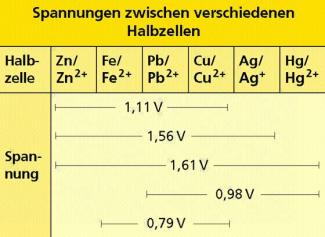
Das galvanische Element ist eine elektrochemische Zelle. Es besteht aus zwei miteinander kombinierten Elektroden. Jede elektrochemische Zelle besteht aus zwei Elektroden oder auch aus zwei elektrochemischen Halbzellen, die miteinander elektrisch leitend, z. B. über einen Stromschlüssel, verbunden sind. Der Stromschlüssel enthält eine Elektrolytlösung, z. B. Kaliumchloridlösung oder Kaliumnitratlösung, und ermöglicht den Ladungstransport zwischen den Halbzellen.
Als Stromschlüssel kann auch eine halbdurchlässige Membran verwendet werden, die den Übergang zwischen den beiden Elektrolyten erlaubt.
Werden die beiden Metalle durch einen leitenden Draht verbunden, so fließt durch die Kombination von zwei Elektroden ein elektrischer Strom durch das System, der mit einem Messgerät gemessen werden kann. Chemische Energie wird in elektrische Energie umgewandelt.
In dieser sogenannten galvanischen Zelle läuft eine Redoxreaktion ab:
Oxidation:
Reduktion:
Gesamtreaktion:
-
Mehrere Monozellen bilden eine Batterie
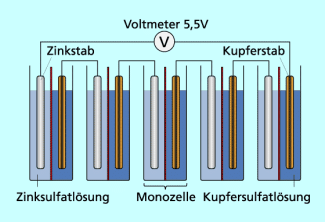
Das Daniell-Element liefert eine positive Zellspannung von etwas mehr als 1 V und diente im 19. Jh. als eine der ersten Batterien in der damaligen Elektrotechnik. Es wurde später durch das leistungsfähigere Leclanché-Element abgelöst, das auch als Zink-Kohle-Batterie bekannt geworden ist.
Zink-Kohle-Batterie
Die noch heute gebräuchliche Zink-Kohle-Batterie basiert auf einer Idee, die der französischen Chemiker GEORGES LECLANCHÉ um 1865 hatte.
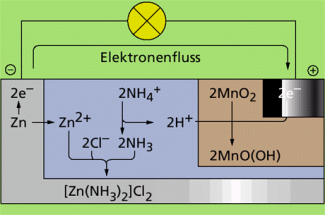
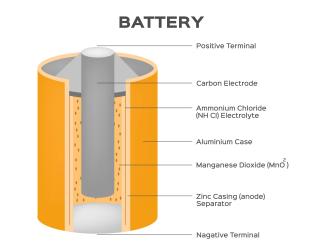
Der Minuspol der Batterie besteht aus einem Zinkbecher. Den Pluspol bildet ein Grafitstab (Kohlestab) der von Braunstein (Mangan(IV)-oxid) umgeben ist. Als Elektrolyt wird eine Ammoniumchloridlösung verwendet. GEORGES LECLANCHÉ verrührte diese Lösung mit Stärke zu einer Masse. Dadurch können die Ionen sich zwar noch bewegen, ein Auslaufen der Batterie erfolgt im Normalfall allerdings nicht.
-
Zink-Kohle-Batterie
gritsalak - adobe stock
Alkali-Mangan-Batterien
Heute nutzen wir hauptsächlich Alkali-Mangan-Batterien für Taschenlampen, Computermäuse oder Fernbedienungen. Allein in Deutschland werden jährlich über 800 Mio. dieser Batterien in unterschiedlichen Bauformen – von der Knopfzelle bis zum 9 V-Block – verkauft.
Bei näherer Betrachtung handelt es sich bei Alkali-Mangan-Batterien um Zink-Mangandioxid-Zellen mit alkalischem Elektrolyten. Die Elektrodenreaktionen ähneln denen der Zink-Kohle-Batterie.
Mangandioxid wird am als Pluspol (Katode) fungierenden Stahlmantel der Batterie zu Mangandioxidhydroxid reduziert.
Als Minuspol (Anode) dient ein Ableitnagel, der in Kontakt mit zinkhaltigem Kaliumhydroxidgel steht. Bei der Oxidation bilden sich zunächst Zink-Ionen, die mit Hydroxid-Ionen in einem komplexen Mechanismus letztlich zu festem Zinkoxid reagieren. Daraus ergibt sich folgende Gesamt- bzw. Zellreaktion:
Die bei der Oxidation abgegebenen Elektronen wandern über einen Metallstift zum Verbraucher, z. B. einer Glühlampe. Über den geschlossenen Stromkreis gelangen sie zum Pluspol (Katode) und werden vom Mangandioxid aufgenommen. Der Ladungsausgleich erfolgt durch den Übergang der Hydroxid-Ionen durch ionendurchlässiges Faserpapier in das Zink-Kaliumhydroxidgel. Der metallische Mantel ist leitend mit dem Pluspol verbunden. Er nimmt anders als bei älteren Zink-Kohle-Batterien nicht an der Elektrodenreaktion teil. Folglich kann der Stahlmantel nicht porös werden und die Alkali-Mangan-Batterie ist auslaufsicher.
Die aus der Zellreaktion resultierende Nennspannung beträgt 1,5 V. Je nach Belastung sinkt sie nach mehreren Stunden unter 0,8 V.
Die Entladung erfolgt jedoch deutlich langsamer als bei Zink-Kohle-Batterien, weil durch die hohe Oberfläche des Zinkpulvers pro Zeiteinheit mehr Zink oxidiert werden kann. Dadurch sind höhere Entladeströme über längere Zeit möglich.
Durch Reihenschaltung mehrerer Monozellen erreichen Alkali-Mangan-Batterien vielfache Nennspannungen von 1,5 V, z. B. 6 * 1,5 V = 9 V bei der handelsüblichen 9 V-Blockbatterie.
Knopfzellen
Vor allem wenn – wie in Armbanduhren oder Fernbedienungen von Autos – langlebige Energiequellen mit geringer Leistung benötigt werden, nutzt man Knopfzellen. Dazu eignen sich Alkali-Mangan-Zellen nur bedingt.
Deshalb bestehen Knopfzellen häufig aus anderen Elektrodenmaterialien wie beispielsweise die weit verbreiteten Zink-Silberoxid-Batterien.
Als Oxidationsmittel für Knopfzellen diente früher giftiges Quecksilber(II)-oxid, das aber in Europa nicht mehr eingesetzt werden darf.
In den heute gebräuchlichen Zink-Silberoxid-Batterien wird an der Katode (Pluspol) Silberoxid reduziert. Anodisch (am Minuspol) erfolgt – ähnlich wie bei der Alkali-Mangan-Batterie – die Oxidation von Zink. Als Elektrolyt verwendet man Kalilauge. Die Zellreaktion liefert eine Spannung von ca. 1,55 V.
Hörgeräte werden fast ausschließlich mit Zink-Luft-Batterien betrieben. Aufgrund ihrer relativ hohen Leistung und der während der gesamten Entladung fast konstanten Spannung sind sie für die medizinische Anwendung optimal geeignet. Entsprechend der Gesamtreaktion können Zink-Luft-Knopfzellen theoretisch eine Nennspannung von 1,65 V erreichen. Durch Verringerung der Luftzufuhr wird die Spannung auf 1,35 bis 1,4 V reduziert und so u. a. die Lebensdauer verlängert.
Lithium-Batterien
Mit dem negativsten Elektrodenpotenzial (E 0(Li/Li+) = -3,04 V) und der höchsten Entladekapazität ist Lithium ein ideales Anodenmaterial für Batterien. Die heftige Reaktion von Lithium mit Wasser erfordert aber die Verwendung von organischen Lösemitteln oder festen Elektrolyten. Die wegen hoher Fertigungskosten teuren Batterien sind sehr leistungsfähig und können über zehn Jahre halten.
Sie werden in Fotoapparaten, Computern und sogar in Herzschrittmachern eingesetzt. Es gibt verschiedene Typen von Lithium-Batterien. Die Anode besteht immer aus Lithium, als Katodenmaterial werden u. a. Mangandioxid (U Z ≈ 2,9 V), Iod (UZ ≈ 2,8 V) oder Eisensulfid (UZ ≈ 1,5 V) verwendet.
Der Aufbau und der Elektrolyt variieren mit dem Katodenmaterial. Bei der Entaldung einer Lithium-Eisensulfid-Batterie läuft folgende Gesamtreaktion in der Zelle ab:
Verschiedene Batterien im Überblick:
![]()
-
Vorgänge in der Zink-Kohle-Batterie