Akkumulator
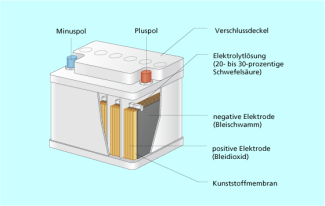
Akkumulatoren (Akkus) sind wieder aufladbare elektrochemische Zellen. In ihnen ist elektrische Energie gespeichert. Sie sorgen als Spannungsquellen für den Antrieb in elektrischen Stromkreisen. Die Wirkungsweise von Akkumulatoren basiert auf elektrische Leitungsvorgänge in Flüssigkeiten und elektrochemische Reaktionen. Die erste Form eines Akkumulators wurde von JOHANN WILHELM RITTER im Jahre 1803 in Jena gebaut. Ein Akkumulator besteht aus 6 zusammen geschalteten gleichen Zellen.
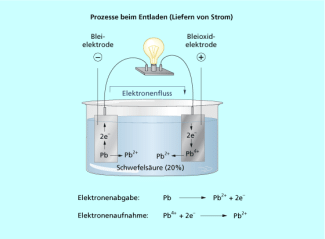
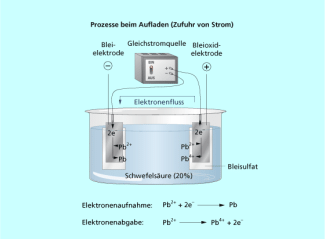
Beim Aufladen des Akkumulators wird elektrische Energie aus dem Netz in chemische Energie umgewandelt und darin gespeichert. Beim Entladen des Akkus kann die elektrische Energie dann wieder entnommen werden. Das klassische Beispiel ist der Bleiakkumulator, der als Starterbatterie für Autos verwendet wird. Beim Laden laufen in einem Elektrolyseprozess an den Elektroden folgende Prozesse ab: An der Anode wird zweiwertiges Blei zu vierwertigem oxidiert und an der Katode werden Blei(II)-Ionen zu metallischem Blei reduziert.
Beim Entladen laufen die Reaktionen freiwillig in umgekehrter Richtung ab. Die Zellspannung beträgt im geladenen Zustand 2,04 V.
In handelsüblichen Starterbatterien sind sechs Zellen hintereinandergeschaltet, um eine Zellspannung von etwa 12 V zu erreichen. Bleiakkumulatoren können eine Lebensdauer von bis zu 20 Jahren erreichen. Wegen ihres hohen Gewichts sind sie aber nur begrenzt einsetzbar.
-
Aufbau eines Akkumulators
Nickel-Cadmium-Akkumulator
Beim Nickel-Cadmium-Akkumulator (Ni-Cd-Akku) besteht die negative Elektrode aus Cadmium, die positive aus Nickeloxidhydroxid. Als Elektrolyt kommt Kaliumhydroxid zum Einsatz. Der Akku weist eine Spannung von ca. 1,3 V auf und kann bis zu 700-mal wieder aufgeladen werden. Entsprechend der Stellung in der Spannungsreihe ist Cadmium der Donator und Nickel der Akzeptor beim Entladevorgang. Beim Laden werden die in der galvanischen Zelle freiwillig ablaufenden Reaktionen umgekehrt:
Das größte Problem beim Ni-Cd-Akku ist neben dem giftigen Cadmium mit der entsprechenden Entsorgungsproblematik der sogenannte Memory-Effekt: Werden Ni-Cd-Zellen in nicht komplett entladenem Zustand wieder aufgeladen, entsteht eine zweite Entladestufe. Ursache ist die Bildung von Cadmium-Kristallen bei kleinen Ladeströmen auf der Oberfläche der negativen Cadmiumelektrode. Beim nächsten Entladevorgang „erinnert“ sich die Batterie nur noch an diese reduzierte Kapazität. Vorsicht ist auch vor einer Überladung geboten, da dann die Elektrolyse von Wasser abläuft, jedoch kann der entstehende Sauerstoff als Cd(OH)2 gebunden werden, sodass die Zellen trotzdem gasdicht sind. Durch weitere Nebenreaktionen (z. B. anodische Bildung von NiO2 und O2) altert der Akku und verliert Kapazität.
Heute wird in mobilen elektrischen Geräten überwiegend der Nickel-Metallhydrid-Akku (NiMeH-Akku) eingesetzt, der ohne das hochgiftige Schwermetall Cadmium auskommt. Der Minuspol beim NiMeH-Akku besteht aus einer Legierung (z. B. Ni/La oder Ti/Zr), die bei Raumtemperatur reversibel Wasserstoff in Form des Metallhydrids (MeHx) speichern kann. Beim Entladevorgang werden die Hydrid-Ionen (OZ = -I) oxidiert, sodass der Minuspol als Anode fungiert.
Durch Überdimensionierung der MeHx-Elektrode gegenüber der NiOOH-Elektrode wird verhindert, dass gegen Ende der Entladung anstelle von Wasserstoff Metalle aus der Elektrodenlegierung oxidiert werden. Vorteile des Ni-MeH-Akkus sind neben der geringeren Umweltbelastung eine höhere Leistung und eine längere Lebensdauer von bis zu 1 000 Ladung-/Entladungszyklen. Außerdem tritt bei unvollständiger Entladung kein Memory-Effekt auf.
-
Laden eines Akkumulators
Lithium-Ionen-Akkumulatoren
Lithium-Ionen-Akkumulatoren (Li-Ionen-Akkus) gehören zu einer neuen Generation galvanischer Energiespeicher. Sie weisen mit 3,8 V eine der höchsten Spannungen, eine größere Speicherkapazität und längere Lebensdauer als Ni-MeH-Akkus auf. An der Redoxreaktion ist nur das Elektrodenmaterial beteiligt, die Lithium-Ionen dienen nur dem Ladungsausgleich zwischen den Polen. Der Pluspol besteht meist aus Mischoxiden wie Li2MnO2 oder Li2CoO2, der Minuspol aus Grafit. Die beiden durch einen Separator räumlich getrennten Elektroden weisen unterschiedliche Redoxpotenziale auf und können reversibel Lithium-Ionen einlagern. Als Elektrolyt dienen wasserfreie organische Lösemittel, in denen ein Lithiumsalz, z. B. LiBF4, gelöst ist.
Beim Laden wird das Nebengruppenmetall im Mischoxid oxidiert und die abgegebenen Elektronen werden vom Grafitgitter aufgenommen. Dabei wandern Lithium-Ionen vom Pluspol zum Minuspol. Sie lagern sich zwischen die Schichten im Grafitgitter ein und kompensieren so die negativen Ladungen im Grafit. Beim Entladen fließen die Elektronen in die entgegengesetzte Richtung und die Lithium-Ionen wandern zum Mischoxid zurück.
Wichtig für die Funktion ist eine Deckschicht auf dem Grafit, die nur durchlässig für Lithium-Ionen ist. Gelangen Lösungsmittelmoleküle infolge einer defekten Deckschicht in das Grafit, wird die Elektrode zerstört.
Lithium-Ionen-Akkus dürfen nicht über 4,2 V geladen und unter 2,5 V entladen werden, daher brauchen sie eine spezielle elektronische Ladungskontrolle.
-
Entladen eines Akkumulators