Bedingungen für Reaktionen
Chemische Reaktionen laufen in unserer Umgebung ständig ab, allerdings nur, wenn bestimmte Voraussetzungen und Bedingungen vorhanden sind. Sonst wäre es nicht zu verstehen, warum man Knallgas unter der Beachtung vorgeschriebener Sicherheitsvorkehrungen herstellen und auch eine Weile aufbewahren kann, warum eine Kerze im geschlossenen Raum erlischt, warum Metallteile in bestimmten Gegenden schneller rosten und warum man Zucker im Gemisch mit ein wenig Zigarettenasche entzünden kann.
Treffen folgende vier Merkmale zu, handelt es sich um eine chemische Reaktion .
- Im makroskopischen Bereich ist eine Stoffumwandlung zu beobachten. Es werden neue Stoffe mit charakteristischen Eigenschaftskombinationen gebildet.
- Damit verbunden ist eine Energieumwandlung. Die Energie der Reaktionsprodukte ist durch Aufnahmen von Energie größer als die Energie der Ausgangsstoffe (endotherme Reaktion) oder durch Energieabgabe geringer als die der Ausgangsstoffe (exotherme Reaktion).
- Die Ursachen für Stoff- und Energieumwandlungen sind nicht mit unseren Sinnerorganen erkennbar. Im submikroskopischen Bereich vollziehen sich Änderungen der Teilchen
- und ein Umbau chemischer Bindungen.
Damit chemische Reaktionen stattfinden, müssen bestimmte Voraussetzungen gegeben sein. Zuerst einmal ist es selbstverständlich, dass alle Ausgangsstoffe vorhanden sein müssen. Außerdem muss sowohl bei endothermen als auch bei exothermen Reaktionen zum Auslösen der chemischen Reaktion Energie zugeführt werden. Das kann Lichtenergie, kinetische Energie, elektrische Energie oder auch thermische Energie sein. Manchmal reicht schon die Temperatur der Umgebung aus. Trotzdem kann man einen Holzklotz sehr viel schwerer zum Brennen bringen als einen Holzspan. Warum erst immer Energie zugeführt werden muss und warum sich der Holzklotz trotz Energiezufuhr schlechter entzünden lässt als der Span, kann mithilfe der Stoßtheorie erklärt werden. Dieses Modell hilft, sich Prozesse im submikroskopischen Bereich vorzustellen.
Stoßtheorie
- Teilchen werden als starre Körper angenommen, die sich ungeordnet bewegen. Bei steigender Temperatur nimmt die Bewegung zu.
- Teilchen stoßen durch die Bewegung zusammen.
- Damit eine Reaktion erfolgt, müssen die Teilchen wirksam zusammenstoßen. Dazu benötigen sie eine Mindestenergie und müssen in bestimmter Weise zueinander ausgerichtet sein.
- Je häufiger wirksame Zusammenstöße in einer bestimmten Zeiteinheit erfolgen, desto schneller reagieren Ausgangsstoffe miteinander.
-
Ob Teilchen wirksam zusammenstoßen, hängt von ihrer Geschwindigkeit und ihrer Lage zueinander ab.
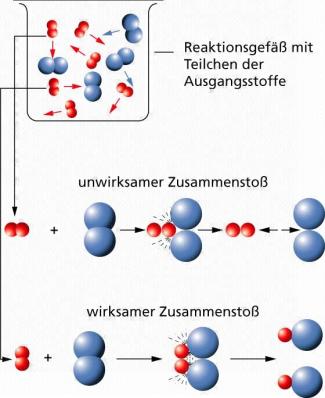
Bei explosiven Gemischen wie z B. beim Knallgas genügt ein Funke, um das Gemisch zu zünden. Dieser Zündfunke muss jedoch vorhanden sein. Bei tiefen Temperaturen kann ein Knallgasgemisch gefahrlos aufbewahrt werden. Wird es aber über einen bestimmten Punkt hinaus erwärmt, erfolgt die Reaktion sehr heftig. Die Teilchen der Ausgangsstoffe müssen erst durch Zufuhr von Energie aktiviert werden. Erst in dem aktivierten Zustand stoßen sie wirksam zusammen und reagieren miteinander. Die dazu notwendige Energie bezeichnet man als Aktivierungsenergie.
Im Falle explosiver Gemische kann die Aktivierungsenergie durch einen Funken, aber auch durch einen Lichtblitz oder einen Schlag zugeführt werden. Beim Rosten von Eisen reicht die thermische Energie der Umgebung aus, um die Teilchen zu aktivieren. Für endotherme Reaktionen ist eine ständige Energiezufuhr nötig, da bei der Reaktion selbst nicht genug Energie frei wird, um weitere Teilchen der Ausgangsstoffe in den aktivierten Zustand zu versetzen. Dabei muss es sich ebenfalls nicht immer um thermische Energie handelt. Bei der Fotosynthese wird die Energie des Lichts genutzt. Zudem bewegen sich die Teilchen bei höherer Temperatur schneller und stoßen somit öfter zusammen.
Wesentlich ist auch die Durchmischung der Ausgangsstoffe und im Zusammenhang damit ihr Zerteilungsgrad. Damit Teilchen miteinander reagieren können, müssen sie miteinander in Kontakt kommen. Je feiner verteilt die Stoffe sind, desto größer ist die Oberfläche und desto eher erfolgt eine Reaktion. Beim Entzünden eines Feuers lässt sich der Effekt beobachten. Einen Holzklotz bekommt man nicht mit einem Streichholz angezündet. Eine Anzahl kleinerer Holzspäne zum Brennen zu bringen ist einfach. Bei Metallen lässt sich Ähnliches beobachten. Ein Eisenstück brennt nicht. Bläst man Eisenpulver in eine Flamme oder hält Eisenwolle in die Brennerflamme, brennt auch Eisen.
Der Verlauf der chemischen Reaktion hängt jedoch nicht nur von der Art der Ausgangstoffe ab, sondern auch von den herrschenden Reaktionsbedingungen, unter denen die Ausgangsstoffe miteinander in Kontakt gebracht werden.
Ist bei einem Laborexperiment einer der Ausgangsstoffe aufgebraucht, läuft die Reaktion nicht weiter ab. Im Zusammenhang damit spielt auch die Konzentration der Stoffe als eine Reaktionsbedingung eine wichtige Rolle. Stülpt man beispielsweise ein Behältnis über eine brennende Kerze, geht sie aus. Das heißt nicht, dass der Sauerstoff schon vollständig verbraucht ist, sondern dass die Konzentration des Sauerstoffs zu gering und die des entstandenen Kohlenstoffdioxids zu hoch ist und deshalb keine Reaktion mehr erfolgen kann. Bei der Verbrennung von Wasserstoff ist der Anteil der Gase Sauerstoff und Wasserstoff im Gemisch für die Heftigkeit der Reaktion entscheidend. Auch bei der Reaktion von Metallen mit Sauerstoff kann man dieses Phänomen beobachten. Die Reaktion in reinem Sauerstoff verläuft heftiger als die Reaktion in Luft.
Neben der Konzentration spielen noch andere Reaktionsbedingungen eine Rolle. Die Temperatur ist nicht nur für die Aktivierung der Teilchen wesentlich. Bei hoher Temperatur bewegen sich die Teilchen schneller. Daher können sie öfter zusammenstoßen und es kommt auch öfter zu wirksamen Zusammenstößen.
Außer der Temperatur und Konzentration zählt bei chemischen Reaktionen, an denen Gase beteiligt sind, auch der Druck zu den Reaktionsbedingungen.
Verändert man die Reaktionsbedingungen (Konzentration, Temperatur, gegebenenfalls Druck) kann der Verlauf einer chemischen Reaktion gezielt beeinflusst werden.
Mithilfe von Katalysatoren wird auf den Verlauf chemischer Reaktionen ebenfalls Einfluss genommen. Durch Katalysatoren kann die Aktivierungsenergie herabgesetzt werden. Dadurch können manche Stoffe überhaupt erst oder bei relativ niedrigen Temperaturen zur Reaktion gebracht werden. Beispielsweise lässt sich Zucker verbrennen, wenn man als Katalysator etwas Asche hinzugibt.
-
Eine Kerze erlischt im geschlossenen Gefäß.


