Stickstoff und Stickstoffverbindungen
Stickstoff ist ein Element der V. Hauptgruppe und mit einem Anteil von 78,1 Vol-% Hauptbestandteil der Luft. Stickstoffverbindungen sind technisch von besonderer Bedeutung. Nitrate werden hauptsächlich als Düngemittel in der Landwirtschaft, aber auch für die Herstellung von Sprengstoffen, Kunststoffen und Farbstoffen eingesetzt.
Ausgangsstoff für die meisten industriell genutzten Stickstoffverbindungen ist Ammoniak. Damit stellt die Ammoniaksynthese nach dem HABER-BOSCH-Verfahren eines der wichtigsten chemischen Verfahren dar.
Die Oxide des Stickstoffs sind in vielen Abgasen enthalten und tragen zur Entstehung des sauren Regens bei. Auch die in den Düngemitteln enthaltenen Nitrate haben bei unkontrollierter Anwendung ein Umwelt schädigendes Potenzial.
Wichtige organische Stickstoffverbindungen sind Eiweiße und die organischen Amine, die zur Herstellung von Farbstoffen und Kunststoffen verwendet werden.
Das Stickstoffatom besitzt 7 Protonen und meist 7 Neutronen im Atomkern sowie 7 Elektronen in der Atomhülle. Auf der ersten Elektronenschale befinden sich zwei und auf der zweiten Elektronenschale fünf Elektronen, sodass Stickstoff über fünf Außenelektronen verfügt.
Um eine stabile Elektronenanordnung, die Achterschale des Neons, zu erreichen, muss ein Stickstoffatom drei weitere Elektronen von Bindungspartnern aufnehmen. Mit stark elektropositiven Partnern bildet Stickstoff dreifach negativ geladene Nitride, z. B. . In der Regel wird das Elektronenoktett aber durch Atombindungen erreicht. Wie alle Elemente der 2. Periode des PSE kann Stickstoff nur maximal vier Atombindungen eingehen.
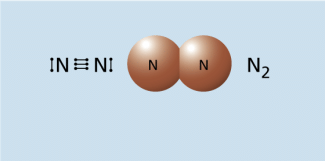
Das Element Stickstoff kommt immer als Molekül vor, das aus zwei Stickstoffatomen besteht. Die Atome sind durch drei gemeinsame Elektronenpaare miteinander verbunden. Jedes Stickstoffatom besitzt noch zwei nichtbindende Elektronen. Die Dreifachbindung ist eine unpolare Atombindung und außerordentlich stabil (Bild 2).
Das Element Stickstoff ist ein farbloses, geruchloses, nicht brennbares Gas. Aus der Eigenschaft Flammen und Lebewesen zu ersticken, hat sich der Name des Elements ergeben. Es wurde im 18. Jahrhunderts von mehreren Chemikern, z. B. M. W. LOMONOSSOW, K. SCHEELE, H. CAVENDISH und A. L. DE LAVOISIER unabhängig voneinander entdeckt.
Reaktionen des Stickstoffs
Stickstoff ist ein typisches Nichtmetall. Aufgrund der stabilen unpolaren Dreifachbindung ist es außerordentlich reaktionsträge. Bei Zimmertemperatur reagiert das Gas nur mit sehr unedlen Metallen zu Nitriden.
Mit Wasserstoff und Sauerstoff reagiert Stickstoff nur nach entsprechender Aktivierung z. B. durch einen Katalysator. Mit Wasser erfolgt gar keine Reaktion.
Stickstoff ist der Hauptbestandteil der Luft . Das Gas hat einen Anteil von 78,1 Vol.-% in der Atmosphäre. Flüssiger Stickstoff wird technisch durch Verflüssigung der Luft und anschließende fraktionierte Destillation gewonnen. Eine andere Möglichkeit besteht darin, den Luftsauerstoff mit Kohle zu Kohlenstoffdioxid umzusetzen. Dieses kann man leicht aus dem Gasgemisch abtrennen und erhält so gasförmigen Stickstoff.
Daneben wird Stickstoff als Schutzgas, z. B. zur Konservierung von Fleisch in der Lebensmittelindustrie, verwendet. Auch in der chemischen Industrie und in Laboratorien benutzt man Stickstoff, um durch Luft oxidierbare oder feuchtigkeitsempfindliche Substanzen zu „schützen“.
Flüssiger Stickstoff hat eine Siedetemperatur von -196 °C und dient in der Kältetechnik zur Konservierung von Zellen und z. T. sogar schon von Organen.
-
Valenzstrichformel und Kalottenmodell des Stickstoffmoleküls
Stickstoff-Sauerstoff-Verbindungen
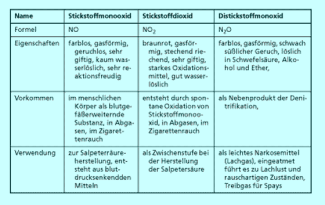
Mit Sauerstoff bildet Stickstoff verschiedene Oxide, die sogenannten Stickoxide. Die wichtigsten Stickstoffoxide (Bild 3) sind Distickstoffmonooxid (), Stickstoffmonooxid (NO) und Stickstoffdioxid (). Gemische aus NO und nennt man nitrose Gase oder auch .
Stickstoffmonooxid wird mit Luftsauerstoff zu Stickstoffdioxid oxidiert.
Wie alle Nichtmetalloxide, reagieren die Oxide des Stickstoffs mit Wasser zu verschiedenen Säuren. Sie werden deshalb auch als saure Gase bezeichnet.
-
Eigenschaften wichtiger Oxide des Stickstoffs
Nitrose Gase sind in Abgasen von Autos, industriellen Verbrennungsprozessen und Synthesen enthalten. Sie schädigen die Umwelt zum einen durch die Säurebildung mit der Luftfeuchte, durch die sie zur Entstehung des sauren Regen beitragen. Zum anderen sind nitrose Gase sehr reaktiv und bilden mit Sauerstoff unter bestimmten Bedingungen Ozon. Die erhöhte Ozonkonzentration in Bodennähe ist die Hauptursache für den Sommersmog bzw. Fotosmog.
Technische Verwendung finden die nitrosen Gase fast ausschließlich bei der Herstellung von Salpetersäure. In einigen anderen industriellen Prozessen ist ihre Entstehung unerwünscht, da sie eine aufwändige Reinigung der Abgase erfordert.
Distickstoffmonooxid (Lachgas, ) wird in der Medizin zur Unterstützung anderer Narkosemittel verwendet.
Salpetersäure () ist eine starke Säure, die mit Wasser zu Oxonium-Ionen und Nitrat- Ionen reagiert.
Reine Salpetersäure (98-100 %) ist eine farblose, stark ätzende Flüssigkeit und wirkt als starkes Oxidationsmittel. Sie kann rotbraunes Stickstoffdioxid enthalten, das beim Öffnen der Flasche unter Rauchbildung entweicht. Deshalb wird die hoch konzentrierte Säure auch rote, rauchende Salpetersäure genannt. Salpetersäure bildet mit Wasser ein konstant siedendes Gemisch (Azeotrop) mit einem Gehalt von ca. 70 % HNO3. Somit kann man bei der Herstellung nach dem Ostwald-Verfahren bei der Destillation nur Säure mit maximal dieser Konzentration erzielen. Die üblicherweise als konzentrierte Salpetersäure bezeichnete Säure hat daher einen Gehalt von 68-70 % HNO3. Reine Salpetersäure (98-100 %) wird nach einem besonderen Verfahren hergestellt.
Im Labor werden konzentrierte (68 %) und verdünnte (12 %) Salpetersäure verwendet. Konzentrierte Salpetersäure wirkt ebenfalls stark ätzend und oxidierend. Auf Grund dessen löst die konzentrierte Säure Edelmetalle wie Kupfer und Silber, aber nicht Gold und Platin. Salpetersäure wird zur Herstellung von Düngemitteln, Kunstfasern, Nitrolacken, Farbstoffen und Explosivstoffen verwendet.
Verdünnte Salpetersäure ist eine farblose Flüssigkeit, stark sauer und reagiert mit unedlen Metallen zu Nitraten.
Die Salze der Salpetersäure heißen Nitrate.
Nitrate bestehen aus positiv geladenen Metall- oder Ammonium-Ionen und negativ geladenen Nitrat- Ionen. Sie entstehen entweder durch Reaktion der Säure mit Metallen oder indem Salpetersäure mit entsprechenden Carbonaten oder Hydroxiden umgesetzt wird.
Alle Nitrate sind wasserlösliche Salze, sie dissoziieren in Metall-Ionen und Nitrat-Ionen.
Wichtige Nitrate sind Kaliumnitrat, Natriumnitrat und Ammoniumnitrat.
Kaliumnitrat, ein weißes, kristallines Salz, wird auch als „Salpeter“ bezeichnet. Schon vor Jahrhunderten verwendete man es zur Herstellung von Schwarzpulver. Auch heute noch ist es ein Ausgangsstoff für Sprengstoffe und wird außerdem für Kunststoffe und Farbstoffe gebraucht.
Natriumnitrat ist ein weißes, kristallines Salz. Es ist Hauptbestandteil des Chilesalpeters. Natriumnitrat wird als Düngemittel und zur Herstellung von Feuerwerk verwendet.
Ammoniumnitrat zerfällt beim Erhitzen explosionsartig. Ammoniumnitrat ist ein idealer Stickstoffdünger. Nach dem Sprengstoffgesetz darf es aber nur als Gemisch mit anderen Zusätzen, wie z. B. Kalk eingesetzt werden. Das verhindert u. a. die Explosion des reinen Nitrats.
Weitere Stickstoffverbindungen
Ammoniak ist die wichtigste Stickstoff-Wasserstoff-Verbindung, da daraus technisch fast alle anderen Stickstoffverbindungen hergestellt werden. Das Ammoniakmolekül besteht aus einem Atom Stickstoff und drei Atomen Wasserstoff, die durch polare Atombindungen verbunden sind.
Ammoniak ist farblos, gasförmig, mit charakteristischem Geruch und gut wasserlöslich. Die wässrige Lösung reagiert schwach basisch. Ammoniak ist nach Brönstedt eine Base und entzieht dem Wasser ein Wasserstoff-Ion (Proton), sodass ein Hydroxid-Ion entsteht.
Flüssiger Ammoniak ist ähnlich wie Wasser ein gutes Lösungsmittel für polare Stoffe. Es unterliegt ebenfalls in geringem Maße der Autoprotolyse in Ammoniumionen und Amidionen.
Ammoniak wird technisch ausschließlich nach dem 1913 entwickelten HABER-BOSCH-Verfahren gewonnen. Dieses Verfahren ermöglichte es Deutschland, die zur Waffenproduktion notwendigen Nitrate während des ersten Weltkriegs unter Umgehung des Handelsembargos selbst herzustellen.
Ammoniak wird zu etwa 80 % für die Herstellung von Stickstoffdüngemitteln gebraucht. Außerdem dient es zur Herstellung von Kunststoffen, Sprengstoffen auf Nitratbasis und Pflanzenschutzmitteln.
-
Gülledüngung gehört zur organischen Düngung und schont die Bodenstruktur. Der Dünger wird durch Spritzanlagen gleichmäßig auf der Nutzfläche verteilt.

Boris Mahler, Berlin
Stickstoff kommt auf der Erde nicht nur in anorganischen Verbindungen vor. In verschiedenen organischen Stoffen, z. B. Aminen und Harnstoff ist ebenfalls Stickstoff gebunden. Alle Eiweiße sind aus Stickstoff enthaltenden Aminosäuren aufgebaut, die über Peptidbindungen miteinander verknüpft sind. Luftstickstoff, anorganisch und organisch gebundener Stickstoff stehen über einen Stickstoffkreislauf in Verbindung.

