Benzen
Der Kohlenwasserstoff Benzen wurde 1825 von M. Faraday entdeckt. Die theoretische Erklärung der aromatischen Struktur gelang erst im 20. Jh. mithilfe der modernen Wellenmechanik. Durch den aromatischen Zustand ist das Benzen relativ reaktionsträge. Typische Reaktionen von Benzen sind elektrophile Substitutionen am Aromaten. Benzen ist ein bedeutender Ausgangsstoff für die chemische Industrie. Es ist der Prototyp aromatischer Verbindungen.
Benzen kann man als den Prototypen der aromatischen Verbindungen bezeichnen. Die Summenformel ist . Die Kohlenstoffatome sind in einem regulären Sechseck miteinander verbunden. Jedes Kohlenstoffatom hat noch eine Bindung zu einem Wasserstoffatom. Mit der vierten Valenz bilden die sechs Kohlenstoffatome ein Elektronensextett.
Geschichte
Der Kohlenwasserstoff Benzen (Benzol) wurde 1825 von MICHAEL FARADAY aus den öligen Kondensaten isoliert, die sich aus Leuchtgas abscheiden. M. FARADAY erkannte auch, dass die Verbindung aus der gleichen Anzahl Kohlenstoff- und Wasserstoffatomen zusammen gesetzt ist.
Der deutsche Chemiker E. A. MITSCHERLICH bestimmte 1834 die Summenformel und konnte außerdem nachweisen, dass die Verbindung auch beim Erhitzen von Benzoesäure mit Kalk entsteht.
Die Verbindung erhielt im Deutschen den Namen Benzol im England wurde sie „benzene“ genannt um Verwechslungen mit den Alkoholen , die die Endung -ol tragen zu vermeiden. Deshalb wird auch im deutschsprachigen Raum heute überwiegend der Name Benzen benutzt.
Es folgten weitere Darstellungen von Aromaten und es wurden ständig neue Verbindungen entdeckt, die mit dem Benzen strukturell verwandt waren.
Schon seit der Entdeckung des Benzen war den Chemikern des 19. Jh. klar, dass im Benzen und seinen Derivaten etwas fundamental Neuartiges lag. Die Summenformel war klar und konnte bestätigt werden. Ein gesättigter Kohlenwasserstoff mit sechs Kohlenstoffatomen hat die Summenformel ein gesättigter cyclischer Kohlenwasserstoff hat die Summenformel Also musste es sich beim Benzen um eine Verbindung mit mehreren Doppelbindungen (Polyenstruktur) handeln.
Hier allerdings widersprachen die experimentellen Befunde zur Reaktivität des Benzens den theoretischen Überlegungen zur Struktur. Benzen reagiert nicht mit wässrigem Kaliumpermanganat und auch nicht mit Bromwasser. Dies sind aber typische Nachweisreaktionen für ungesättigte Verbindungen. Auch in der Kälte reagiert Benzen nicht einmal mit konzentrierter Schwefelsäure. Deshalb wurden im Lauf der Zeit viele Strukturen für das Benzen vorgeschlagen und auch wieder verworfen.
![]()
-
Steckbrief von Benzen

Struktur des Benzens
Lange Zeit entschied man sich für die von A. KEKULÉ vorgeschlagene Struktur
.
Erst 1973 gelang es Chemikern der Columbia Universität, die Substanz mit der von A. LADENBURG vorgeschlagenen Struktur (dem „LADENBURG-Benzen“ oder 3-Prisman) zu synthetisieren. Dabei zeigte sich, dass die Verbindung relativ stabil ist und erst bei 90 °C zum Benzen isomerisiert. Auch das „DEWAR-Benzen“ konnte 1962 synthetisiert und nachgewiesen werden.
Durch die moderne Wellenmechanik des 20. Jahrhunderts konnte die Struktur des Benzens mit Hilfe der Elektronentheorie erklärt werden. Unterstützt wurde dies durch die Röntgenkristallstrukturuntersuchung. So konnte nachgewiesen werden, dass die Struktur des Benzens wirklich einem regulären Sechseck
, wie von KEKULÉ vorgeschlagen, entspricht. Die „vierte Valenz“ der Kohlenstoffatome, die die Chemiker des 19. Jh. nur unzureichend erklären konnten, wird heute als p-Bindung von Orbitalen erkannt, die sich gleichmäßig um den Ring ausdehnt.
![]()
Was unterscheidet nun die „Benzen-Struktur“ von der „Cyclohexatrien-Struktur“?
Ausgangspunkt müssen die experimentellen Daten sein. Hier wurde festgestellt, dass Benzen nicht wie andere Olefine mit Bromwasser oder Kaliumpermanganat-Lösung reagiert. Das heißt, Benzen muss wesentlich stabiler sein als das hypothetische Cyclohexatrien.
Eine grobe Abschätzung dieser zusätzlichen Stabilisierung im Benzen erhält man durch die Hydrierungswärmen. Bei der Hydrierung von Cyclohexen zu Cyclohexan wird eine Reaktionswärme von 120 kJ/mol frei. Geht man nun ganz pragmatisch vor, und sagt im hypothetischen Cyclohexatrien sind drei Doppelbindungen, müssen demzufolge 360 kJ/mol frei werden.
Führt man das Experiment durch, und hydriert Benzen, kann nur eine Reaktionswärme von 209 kJ/mol bestimmt werden. Die Differenz zum theoretisch erwarteten Wert von 151 kJ/mol bezeichnet man als Mesomerieenergie oder Resonanzenergie. Die Mesomerieenergie wird durch die Delokalisierung der Elektronen in den p-Orbitalen über den gesamten Ring frei. Es gibt keine lokalisierten Doppelbindungen im Benzen, sondern nur noch eine Bindung über den gesamten Ring. Im nachfolgenden Energie-Diagramm ist dies noch grafisch dargestellt.
![]()
Die Mesomerieenergie
Die Mesomerieenergie ist die Ursache für die „Reaktionsträgheit“ des Benzens. Aus der Energie-Betrachtung wird deutlich, warum sich Benzen anders verhält als Olefine. Bei allen Reaktionen am Benzen findet analog zur elektrophilen Addition bei Olefinen der Angriff eines Elektrophils auf das Elektronensystem statt. Bei der Reaktion am Benzen-Ring muss aber grundsätzlich die Mesomerieenergie aufgebracht werden, da das System vorübergehend zerstört wird. Deshalb sind Aromaten reaktionsträge, da eine hohe Aktivierungsenergie notwendig ist. Im Gegensatz zur elektrophilen Addition bei den Olefinen findet bei aromatischen Verbindungen immer eine elektrophile Substitution statt. Nur bei der elektrophile Substitution kann die Mesomerieenergie nach der Reaktion zurückgewonnen werden.
![]()
Herstellung und Verwendung
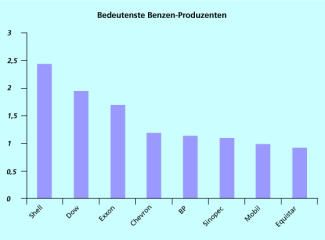
Benzen wird vorwiegend bei den Reforming- und Pyrolyse-Prozessen in der Erdölverarbeitung gewonnen. Die Weltjahresproduktion betrug 2007 ca. 45 Mio. t. Die bedeutendsten Firmen sind Petrochemiefirmen.
Benzen ist der Ausgangsstoff für eine Vielzahl an Substanzen. Alle substituierten Benzene werden durch elektrophile Substitutionen gewonnen. Die größte technische Bedeutung hat die Produktion von Ethylbenzen, dem Vorprodukt für die Styren-Synthese.
-
Die bedeutendsten Benzen-Produzenten
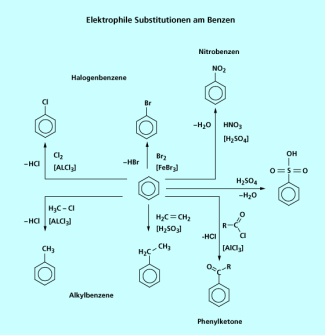
Die elektrophile Substitution
Die typische Reaktion für Benzen ist die elektrophile Substitution
.
Beispiele hierfür sind:
- Die Umsetzung von Benzen mit Chlor in Gegenwart von Aluminium(III)-chlorid als Katalysator zu Chlorbenzen - Chlorierung von Aromaten.
- Umsetzung von Benzen mit Brom in Gegenwart von Eisen(III)-bromid als Katalysator zu Brombenzen - Bromierung von Aromaten.
- Umsetzung von Benzen mit Nitriersäure, einem Gemisch aus konzentrierter Salpetersäure und konzentrierter Schwefelsäure zu Nitrobenzen - Nitrierung.
- Umsetzung von Benzen mit 100%-iger Schwefelsäure oder Oleum (rauchender Schwefelsäure) mit unterschiedlichem Schwefeltrioxid-Gehalt zu Benzensulfonsäure - Sulfonierung.
- Umsetzung von Benzen mit Carbonsäurechloriden in Gegenwart von Aluminium(III)-chlorid als Katalysator zu Phenylketonen - Friedel-Crafts-Acylierungen.
- Umsetzung von Benzen mit Alkenen in Gegenwart von konzentrierter Schwefelsäure als Katalysator zu Alkylbenzenen.
- Umsetzung von Benzen mit Halogenalkanen in Gegenwart von Aluminium(III)-chlorid als Katalysator zu Alkylbenzenen - Friedel-Crafts-Alkylierungen.
-
Elektrophile Substitutionen am Benzen