Dissoziation
Als Dissoziation bezeichnet man die Aufspaltung von Molekülen oder Ionen in kleinere Bestandteile. Sie kann homolytisch oder heterolytisch erfolgen. Die Dissoziation von Stoffen wird durch verschiedene Vorgänge ausgelöst. Sie erfolgt beim Lösen von Stoffen in Wasser oder anderen Lösungsmitteln, kann aber auch durch hohe Temperaturen, elektrische Ströme oder elektromagnetische Strahlung hervorgerufen werden.
Am häufigsten und im Alltag am bedeutendsten ist die Dissoziation von Salzen, Säuren oder Basen in Wasser.
Dissoziation ist der Zerfall eines Stoffes in kleinere Teilchen. Die Trennung (lat.: dissoziato = trennen) kann homolytisch oder heterolytisch erfolgen. So dissoziieren Salze in frei bewegliche Ionen. Moleküle können ebenfalls heterolytisch in Ionen oder homolytisch in Atome dissoziieren.
Die Dissoziation von Stoffen wird durch verschiedene Vorgänge ausgelöst. Sie erfolgt beim Lösen von Stoffen in Wasser, kann aber auch durch hohe Temperaturen und elektrische Ströme hervorgerufen werden.
Am häufigsten und im Alltag am bedeutendsten ist die Dissoziation von Salzen, Säuren oder Basen in Wasser.
-
Auflösung von Kochsalz in Wasser
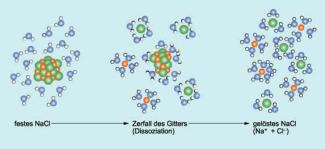
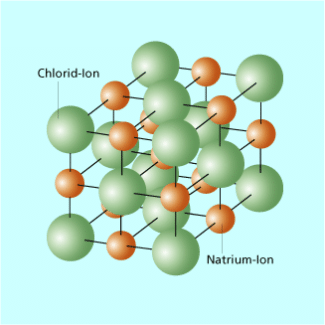
Nachfolgend wird als Beispiel die Dissoziation von Natriumchlorid (Kochsalz) in Wasser näher betrachtet. Im Kristallgefüge werden die einzelnen Natrium- und Chlorid-Ionen durch die gegenseitige elektrostatische Anziehung an ihrem Platz gehalten. Dabei sind die Natrium-Ionen positiv und die Chlorid-Ionen negativ geladen. Gelangt ein Kochsalzkristall in Wasser, dann treten die Ionen an seiner Oberfläche in Wechselwirkung mit den Wassermolekülen. Dabei wirkt sich besonders der Dipol charakter der Wassermoleküle aus. Darunter versteht man folgende Eigenschaft:
-
Gitterstruktur von Kochsalz (NaCl)
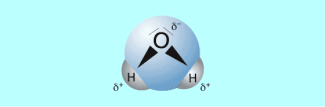
In den Wassermolekül en sind die Wasserstoffatome und die Sauerstoffatome so angeordnet, dass das Wassermolekül, wie ein elektrisch geladener Dipol wirkt. Ursache dieses Dipolcharakters von Wassermolekülen sind die Elektronegativitätsdifferenz zwischen Sauerstoff und Wasserstoff und die Anordnung der Wasserstoffatome zum Sauerstoffatom in einem Bindungswinkel von 104,5°. Dadurch entsteht am Molekülende, an dem sich die Wasserstoffatome befinden, ein positiver Pol und beim Sauerstoffatom ein negativer Pol.
Die Wassermoleküle lagern sich als Dipol so an die Ionen des Natriumchloridkristalls an, dass ihr positiv geladener Pol in Richtung Chlor-Ionen zeigt. Andere Wassermoleküle lagern sich mit ihrem negativ geladener Pol um die Natrium-Ionen herum an.Durch die Wassermoleküle werden die von den Ionen ausgehenden elektrostatischen Kräfte abgeschwächt. Die Ionen an der Oberfläche werden dadurch nicht mehr ausreichend an das Kochsalzgitter gebunden und verlassen es. Kurz darauf umschließen die Wassermoleküle die einzelnen freien Ionen vollständig. Sie bilden eine kleine Wasserhülle um sie, die man auch Hydrathülle nennt. Schritt für Schritt wird nun der ganze Kristall gelöst - er dissoziiert. Die Dissoziationsgleichung lautet in diesem Fall:
Die einzelnen Ionen sind mit ihren Hydrathüllen im Wasser nahezu frei beweglich. Ausreichend durch die geordneten Wassermoleküle ihrer Solvathüllen abgeschirmt beeinflussen sie sich - verglichen mit den Kräften im Kristallgitter - kaum noch gegenseitig.
-
Wassermolekül, bestehend aus Wasserstoff- (H) und Sauerstoffatomen (O)