dritte Hauptgruppe
Zur dritten Hauptgruppe gehören die Elemente Bor, Aluminium, Gallium, Indium und Thallium. Während Bor überwiegend nichtmetallische Eigenschaften aufweist, sind Aluminium, Gallium, Indium und Thallium Metalle. Sie werden auch Erdmetalle genannt.
Aluminium ist nach Eisen das zweitwichtigste Gebrauchsmetall, sein großer Vorzug gegenüber Eisen und Stahl ist sein geringes Gewicht.
Gruppeneigenschaften
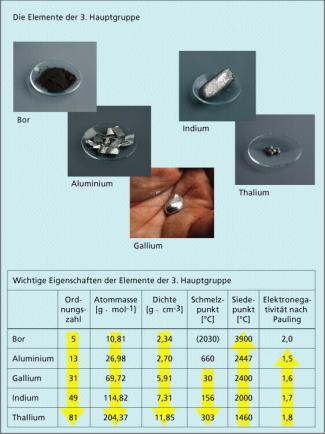
Zu den Elementen der 3. Hauptgruppe zählen Bor (B), Aluminium (Al), Gallium (Ga), Indium (In) und Thallium (Tl).
Die Elemente der 3. Hauptgruppe besitzen drei Außenelektronen, ihre Valenzelektronenkonfiguration beträgt also .
Die Elemente der 3. Hauptgruppe unterscheiden sich voneinander stärker als die Alkalimetalle oder die Erdalkalimetalle untereinander. So ist Bor, das erste Element der 3. Hauptgruppe, ein Halbmetall. Es besitzt viele Eigenschaften, die typisch für Nichtmetalle sind, besonders bei höheren Temperaturen zeigt es jedoch auch metallische Eigenschaften. Die übrigen Elemente der Gruppe sind typische Metalle. Der Metallcharakter nimmt innerhalb der Gruppe nach unten zu.
Mit zunehmendem Metallcharakter nimmt die Elektronegativität ab und die Ordnungszahl steigt, gleichzeitig nimmt der ionische Charakter der Verbindungen zu. Bor als Halbmetall bildet in wässriger Lösung oder in Gittern keine -Ionen aus, sondern liegt kovalent gebunden vor. Bei den schwereren Elementen überwiegen ionische Verbindungen (Salze).
Eigenschaften der einzelnen Elemente
Bor kommt in vier kristallinen Modifikationen vor, außerdem als schwarzbraune amorphe Substanz. Kristallines Bor ist sehr hart und besitzt Halbleitereigenschaften. Es ist reaktionsträge und reagiert erst bei höheren Temperaturen.
Bor ist ein wichtiges Spurenmineral für Pflanzen, es ist notwendig für ihr Wachstum.
-
Die Elemente der 3. Hauptgruppe und Eigenschaften der Elemente
Aluminium ist ein silberweißes Leichtmetall. Da es durch Ausbildung einer dünnen, fest haftenden Oxidschicht passiviert wird, ist es an der Luft beständig.
Aluminium ist nach Eisen das wichtigste Gebrauchsmetall . Aluminium selbst und viele seiner Legierungen zeichnen sich durch eine geringe Dichte, hohe Korrosionsbeständigkeit, gute elektrische Leitfähigkeit und gute Verarbeitbarkeit aus. Aluminium wird daher zur Herstellung von Fahrzeug- und Flugzeugteilen, verschiedensten Konstruktionsmaterialen (Rohre, Kessel, Gerüste, Platten, Kabel), Haushaltsgegenständen (Besteck, Drähte, Folien) und als Korrosionsschutz benutzt. Da Aluminium sehr dehnbar ist, kann es zu Drähten oder dünnen Folien (<0,000 5 mm) verarbeitet werden.
Die elektrische Leitfähigkeit des Aluminium beträgt 66 % von der des Kupfers, es leitet den elektrischen Strom also schlechter als Kupfer. Stromleitungen werden trotzdem auch aus Aluminium gefertigt, da diese nur halb soviel wie vergleichbare Kupferleitungen wiegen.
Aluminium als unedles Metall ist ein relativ starkes Reduktionsmittel. Beim Thermitverfahren (Aluminothermisches Verfahren) dient es beispielsweise zur Reduktion von Eisenoxid .
-
Alufolie

Bei dieser Reaktion wird die hohe Bildungsenthalpie des Aluminiumoxids ausgenutzt, um das Metall gleichzeitig zu schmelzen. Bei Reaktionstemperaturen von mehr als 2 000°C fällt flüssiges Eisen an, das zum Verschweißen z. B. von Schienen verwendet wird.
Auch andere Metalloxide, wie z.b. Chromoxid , aber auch Siliciumoxid lassen sich mit Aluminiumgrieß reduzieren.
Gallium ist ein silberweißes, hartes Metall, das bereits bei 29,78 ºC schmilzt, aber erst bei 2 403 °C siedet. Die Dichte von festem Gallium beträgt 5,91 g/cm³, es ist somit nicht mehr zu den Leichtmetallen zu zählen, die eine Dichte von weniger als 5 g/cm³ aufweisen.
Indium ist ein silberweißes, weiches Metall, das sich mit dem Messer schneiden lässt. Gegenüber Luft ist es beständig. Indium ist für den Menschen giftig.
Thallium ist ein bläulich weißes und weiches Metall.
Die Giftigkeit von Thallium entspricht der von Blei, während Gallium und Aluminium (in der üblichen Verwendungsart) keine toxischen Eigenschaften besitzen.
Vorkommen und Gewinnung
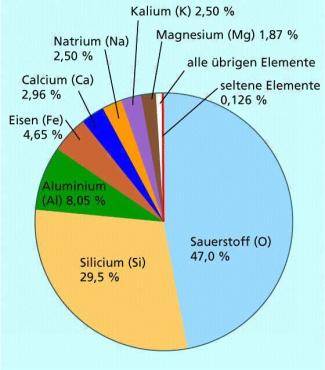
Aluminium ist das dritthäufigste Element überhaupt, in der Erdkruste das häufigste Metall und macht 8,3 % ihrer Masse aus. Die übrigen Elemente der 3. Hauptgruppe sind selten.
Bor wird in der Natur hauptsächlich als Borax oder wasserärmerer Kernit gefunden.
Je nach gewünschter Reinheit werden verschiedene Verfahren zur Gewinnung von Bor angewendet. Vergleichsweise unreines Bor erhält man durch Reduktion von Boroxid mit Magnesium.
Reines Bor lässt sich beispielsweise aus Bortriiodid herstellen, das bei 800 - 1 000 °C an Wolframdrähten thermisch zersetzt wird.
thermische Zersetzung
Technisch wird es meist durch Schmelzflusselektrolyse einer Mischung von , Kaliumchlorid KCl und Boroxid hergestellt.
-
Häufigkeit der Elemente in der Erdkruste
Aluminium kommt in der Natur ebenfalls nicht elementar, sondern nur in Verbindung mit Sauerstoff vor. Die größten Mengen finden sich in Alumosilicaten wie Glimmer und Feldspaten sowie in Tonmineralien (Kaolinite). Außerdem ist Bauxit relativ häufig, ein Gemisch aus dem Hydroxid und dem Oxidhydroxid AlO(OH). Bauxit ist das wichtigste Ausgangsmaterial zur Gewinnung von elementarem Aluminium. Eher selten ist das Oxid (Korund). Wertvolle Edelsteine, nämlich Rubine und Saphire, sind Korundkristalle, die durch Spuren anderer Elemente verunreinigt und daher gefärbt sind.
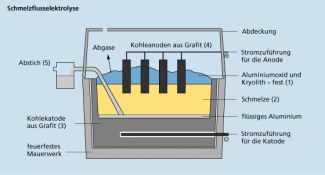
Großtechnisch wird Aluminium durch Schmelzflusselektrolyse einer Lösung von Aluminiumoxid in Kryolith hergestellt. Der an der Anode entstehende Sauerstoff reagiert mit dem Anodenmaterial Grafit, sodass im Prinzip folgende Gesamtreaktion abläuft:
.
Von einem Doppelsalz des Aluminiums, dem Kaliumaluminiumalaun KAl(SO4)2 (Kalialaun, Alaun), der lateinisch alumen heißt, hat Aluminium seinen Namen. Alaun war schon im Altertum bekannt und wurde wegen seiner desinfizierenden und adstringierenden (zusammenziehenden, Blutungen stillenden) Wirkung z. B. bei der Mumifizierung verwendet. Ammoniumaluminiumalaun (Ammon-Alaun) wird als Deokristall verwendet.
Die Elemente Gallium, Indium und Thallium sind weit verbreitet, finden sich aber sehr selten angereichert. Sie kommen in verschiedenen sulfidischen Erzen, häufig mit Zink in der Zinkblende ZnS vor. Weiterhin sind sie mit dem Aluminium im Bauxit vergesellschaftet.
Hergestellt werden sie durch Elektrolyse ihrer Salzlösungen.
Wichtige Verbindungen
Verbindungen von Bor
Eine auch in der Natur vorkommende Verbindung ist die Borsäure .
Diese schwache Säure dissoziiert nicht in Wasser, sondern reagiert deswegen schwach sauer, weil sie ein Hydroxid-Ion aufnimmt.
Auf diese Weise erhält die Borsäure, in der das Boratom dreibindig ist und bei dem es sich somit um eine Elektronenmangelverbindung handelt, ein vollständiges Elektronenoktett.
Eine wichtige Verbindung, die von der Borsäure abgeleitet ist, ist Borax, dessen komplizierte Struktur mit beschrieben werden kann, das jedoch vereinfacht auch durch die Summenformel benannt wird.
Borax wird beim Schweißen und Löten verwendet, da es die Oxidschicht auf Metallen löst. Außerdem wird es zur Herstellung von temperaturfestem Glas, für Keramikglasuren und zur Herstellung von Perboraten, die in Wasch- und Bleichmitteln enthalten sind, verwendet.
Verbindungen von Aluminium
Die sicherlich wichtigste Aluminiumverbindung ist Aluminiumoxid. Es wird aus Aluminiumhydroxid, dem Oxid-Hydroxid oder aus Bauxit gewonnen und dient hauptsächlich zur großtechnischen Gewinnung von Aluminium. Außerdem wird es in der Technik als Trägermaterial für Katalysatoren verwendet und dient zur Herstellung von Schleif- und Poliermitteln. Aus Schmelzen von Aluminiumoxid und kleinen Mengen von Metalloxiden lassen sich künstliche Rubine und Saphire gewinnen.
Basisches Aluminiumacetat wird auch „essigsaure Tonerde“ genannt und in der Medizin z. B. für entzündungshemmende Umschläge verwendet.
-
Schmelzflusselektrolyse zur Herstellung von Aluminium (schematisch)
-
Ägyptische Mumie
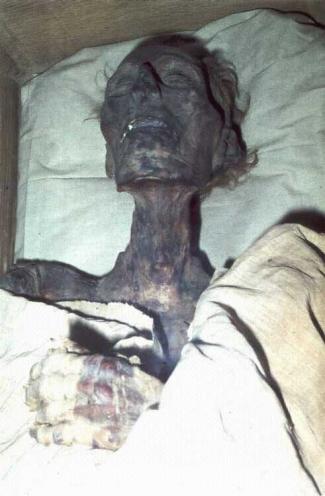
Von einem Doppelsalz des Aluminiums, dem Kaliumaluminiumalaun (Kalialaun, Alaun), der lateinisch alumen heißt, hat Aluminium seinen Namen. Alaun war schon im Altertum bekannt und wurde wegen seiner desinfizierenden und adstringierenden (zusammenziehenden, Blutungen stillenden) Wirkung z. B. bei der Mumifizierung verwendet. Ammoniumaluminiumalaun (Ammon-Alaun ) wird als Deokristall verwendet.
Verbindungen von Gallium, Indium und Thallium
Gallium und Indium zeigen ein ähnliches chemisches Verhalten wie Aluminium, sie bilden an trockener Luft eine schützende Oxidschicht und verbrennen feinverteilt oder mit Sauerstoff unter Druck mit heller Flamme.
Gallium sowie in geringeren Maße auch Indium werden in der Halbleitertechnik als Galliumarsenid (GaAs) eingesetzt. So emittieren LEDs aus Galliumarsenid Strahlung im Infrarotbereich und Photodioden aus diesem Material werden zur Detektion von Wärmestrahlung z. B. in Nachtsichtgeräten eingesetzt. Wird in der Verbindung Galliumarsenid ein Teil des Arsens durch Phosphor ersetzt, verschiebt sich die Emission der LED in den roten bis rot - orangen Bereich. LEDs aus mit Stickstoff dotiertem Galliumphosphid emittieren grünes Licht. Gallium, Indium und Thallium bilden mit zahlreichen Metallen niedrig schmelzende Legierungen und werden als Thermometerflüssigkeiten oder zur Herstellung von Sicherheitsschaltern eingesetzt. Thalliumverbindungen sind sehr giftig, Thallium(I)-sulfat wird als Rattengift verwendet.
-
LED

Suche nach passenden Schlagwörtern
- Alaun
- Aluminium
- Ammon-Alaun
- Borsäure
- Thermitverfahren
- Aluminiumacetat
- Gebrauchsmetall
- Bauxit
- Indiumarsenid
- Gallium
- dritte Hauptgruppe
- Borax
- Indium
- Bor
- Aluminiumoxid
- Passivierung
- Thalliumsulfat
- Perborate
- Elektronegativität
- 3. Hauptgruppe
- Ammoniumaluminiumalaun
- Erdmetalle
- 13. Gruppe
- Schmelzflusselektrolyse
- Kalialaun
- Schrägbeziehung
- Thallium(I)-sulfat
- Elektronenmangelverbindung
- Galliumarsenid
- Kaliumaluminiumalaun
- Thallium

