Elektrode
Eine Elektrode ist ein elektrischer Leiter der im direkten Kontakt mit einem Elektrolyten steht. An der Elektrode erfolgt der Übergang von elektrischen Ladungsträgern (Elektronen oder Ionen) vom Feststoff in Elektrolytlösungen, Schmelzen, aber auch in Gase oder ins Vakuum.
Elektrochemiker bezeichnen als Elektroden häufig auch das gesamte System aus elektrischem Leiter (z. B. Platindraht) und Elektrolytlösung (z. B. Säurelösung).
Elektroden dienen der Zu- oder Abführung von elektrischem Strom in verschiedene Stoffe, z. B. Elektrolytlösungen, Schmelzen, Gase oder evakuierte Räume. Chemiker und Physiker benötigen unterschiedliche Elektroden bei Ihrer Arbeit, sodass sich die Definitionen in den beiden Naturwissenschaften unterscheiden.
In der Elektrochemie sind Elektroden leitende Feststoffe, die im direkten Kontakt mit einem Elektrolyten stehen. An der Elektrode erfolgt der Übergang von elektrischen Ladungsträgern (Elektronen oder Ionen) vom Feststoff auf den Elektrolyten (Bild 1) oder umgekehrt. Der Ladungsträgerübergang ist in der Elektrochemie – anders als in der Physik – immer mit einem Stoffumsatz (Reduktion oder Oxidation) verbunden.
Die Elektrode an der eine Oxidation erfolgt, wird immer als Anode bezeichnet. Bei freiwilligen Elektrodenreaktionen (galvanische Prozesse) ist die Anode negativ, bei erzwungenen Elektrodenreaktionen (elektrolytische Prozesse) ist die Anode positiv geladen.
Die Elektrode, an der eine Reduktion erfolgt, nennt man Katode. Sie stellt den Gegenpol zur Anode dar, sodass ihre Ladung ebenfalls davon abhängt, ob sie zu einer galvanischen Zelle oder einer Elektrolysezelle gehört.
Elektrochemiker bezeichnen als Elektroden häufig auch das gesamte System aus elektrischem Leiter (z. B. Platindraht) und Elektrolytlösung (z. B. Säurelösung). Zwei solche Systeme bilden eine elektrochemische Zelle und werden daher auch Halbzellen genannt.
Galvanische Prozesse
Bei galvanischen Prozessen wird die chemische Energie der reagierenden Stoffe in elektrische Energie umgewandelt. Die Elektrodenreaktionen laufen freiwillig ab. Galvanische Zellen wie das Daniell-Element oder die moderne Brennstoffzelle können daher zur Energiererzeugung genutzt werden. Beispiele sind auch Batterien, die wir zum Betrieb vom Taschenlampen, CD-Playern und anderen elektrischen Geräten im Supermarkt kaufen.
Elektrolytische Prozesse
Bei der Elektrolyse erzwingt man eine chemische Reaktion durch Anlegen einer Gleichspannung. Dabei wird elektrische Energie in chemische Energie umgewandelt. Die Elektrolyse ist die Umkehrung des galvanischen Prozesses. Sie spielt eine bedeutende Rolle bei der Gewinnung von Chlor, Natronlauge, Aluminium und anderen Stoffen in der chemischen Industrie.
-
Durch den Übergang von Ladungsträgern zwischen Elektrode und Elektrolyt bildet sich an der Phasengrenze eine elektrochemische Doppelschicht und damit eine Potenzialdifferenz aus.
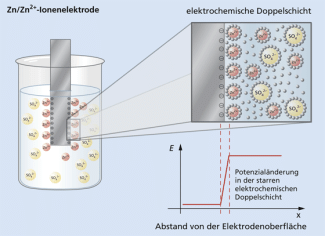
Auch das Aufladen von Akkumulatoren, z. B. fürs Handy oder das Auto, ist ein elektrolytischer Prozess. Der Entladevorgang ist dagegen ein galvanischer Prozess (Bild 2).
Elektroden werden je nach Verwendungszweck als Stab, Platte, Scheibe, Zylinder oder Netz bebaut. Ihre Größen variieren zwischen wenigen Mikrometern und tonnenschweren Zylindern bei der Schmelzflusselektrolyse von Aluminium.
-
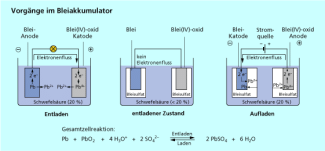
Im Bleiakkumulator erfüllen die Elektroden beim Laden andere Funktionen als beim Entladen.
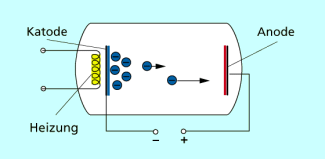
Spezielle Elektroden in der Physik
In der Physik bzw. in der Elektrotechnik nutzt man Elektroden für hauptsächlich für den Stromtransport in Schaltkreisen. Einige spezielle Elektroden dienen dazu, besonders starke Ströme zu erzeugen oder auch elektromagnetische Strahlung bestimmter Wellenlängen. Einige der im Folgenden genannten Elektroden findet man auch in chemischen Analysegeräten (z. B. Spektrometern) wieder.
In Elektronenröhren dienen Katoden zur Emission von Elektronen. Je nach beabsichtigten Zweck kann die verwandte Elektrode in diesen Röhren spezielle Merkmale aufweisen (Bild 3).
Bei spitz zulaufenden Katoden handelt es sich häufig um Feldemissionskatoden. Bei dieser Art von Katoden erreicht die elektrische Feldstärke in der Nähe der Metallspitze sehr hohe Werte. Dadurch werden Elektronen aus dem Katodenmetall emittiert und stehen als frei bewegliche Ladungsträger zur Verfügung.
Unter Ausnutzung der Glühemission arbeiten sogenannte Glühkatoden. Entweder wird die Glühkatode über eine gesonderte Heizwendel erwärmt oder sie ist so konstruiert, dass sie beim Röhrenbetrieb selbst heiß genug wird, um den glühelektrischen Effekt an ihrer Oberfläche auszulösen.
In Fotozellen werden die Katoden durch Lichtbestrahlung zur Elektronenemission angeregt.
-
In Elektronenröhren befinden sich die Anode und Katode im Vakuum. Die negativ geladene Katode emittiert Elektronen, die von der positiv geladenen Anode aufgefangen werden.