Elementaranalyse
Anorganische Stoffe bestehen aus Atomen oder Ionen, die durch verschiedene Methoden nachgewiesen werden können. Dabei unterscheidet man die qualitative Elementaranalyse, bei der zunächst die Art der Bestandteile eines Stoffs ermittelt wird, und die quantitative Elementaranalyse. Bei letzterer bestimmt man die mengenmäßige Zusammensetzung eines reinen Stoffs (Summenformel) oder eines Stoffgemisches.
Anorganische Analyse
Das Ziel einer anorganischen Analyse ist es, zunächst die qualitative Zusammensetzung einer reinen Substanz oder eines Stoffgemisches zu bestimmen. Es werden also bestimmte Elemente oder Ionen durch geeignete Reaktionen nachgewiesen. Die Analyse hat also die Identifizierung eines Reinstoffs oder die Ermittlung der Ionen in einem Stoffgemisch zum Ziel.
Nachweis von Kationen
Durch die Flammenfärbung und durch die spektroskopische Analyse kann man die Elemente der 1. und 2. Hauptgruppe nachweisen. Dazu wird ein ausgeglühtes Magnesiastäbchen mit konzentrierter Salzsäure befeuchtet, die Analysenprobe damit aufgenommen und in die nicht leuchtende Flamme des Bunsenbrenners gehalten. Wenn mehrere Elemente in der Probe gleichzeitig anwesend sind, ist die Flammenfärbung nicht eindeutig. Beim Betrachten der Flamme durch ein Spektroskop erkennt man sie aber anhand ihrer charakteristischen Linien.
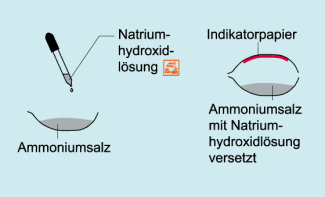
Zum Nachweis von Ammonium-Ionen gibt man zu der Probe auf einem Uhrglas einige Tropfen konzentrierte Natronlauge. Gemäß der Säure-Base-Reaktion
NH4+ + OH- → NH3 + H2O
wird Ammoniak freigesetzt. Dieser ist am Geruch zu erkennen und kann anhand der Blaufärbung von angefeuchtetem Indikatorpapier, das darüber gehalten wird, nachgewiesen werden.
Nachweis von Anionen
Verschiedene Anionen können über eine Fällungsreaktion anhand der Bildung charakteristischer Niederschläge nachgewiesen werden.
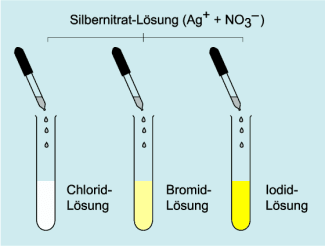
Die Halogenidionen Chlorid, Bromid und Iodid werden aus der wässrigen Lösung der Probe bei Zugabe von Silbernitrat-Lösung ausgefällt. Silberchlorid fällt als weißer Niederschlag, der sich in verdünnter Ammoniaklösung wieder auflöst. Silberbromid ist gelblich-weiß und löst sich erst in konzentrierter Ammoniaklösung, während das gelbe Silberiodid sich darin nicht löst.
Sulfationen werden aus der mit Salzsäure angesäuerten wässrigen Lösung bei Zugabe einer Bariumchloridlösung als weißes Bariumsulfat ausgefällt.
Sulfidionen können indirekt nachgewiesen werden, indem man Salzsäure auf die Probe gibt. Dabei wird Schwefelwasserstoff H2S (Vorsicht! Stark giftig) freigesetzt. Hält man angefeuchtetes Bleiacetat -Papier über die Probe, so färbt sich dieses unter Bildung von Bleisulfid schwarz.
-
Nachweis von Halogenid-Ionen
-
Nachweis von Sulfat-Ionen.

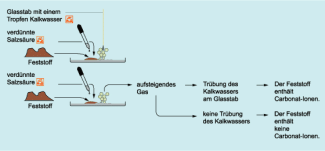
In gleicher Weise kann Carbonat nachgewiesen werden. Bei Zugabe von verdünnter Salzsäure wird aus Carbonaten Kohlenstoffdioxid freigesetzt. Das entweichende Gas trübt einen Tropfen einer Calciumhydroxid- oder Bariumhydroxid-Lösung, der sich an der Spitze eines darüber gehaltenen Glasstabs befindet. Die Trübung wird durch die Bildung von schwer löslichem Calciumcarbonat CaCO3 beziehungsweise Bariumcarbonat BaCO3 hervorgerufen.
Für komplexe Stoffgemische ist es aber meist erforderlich, einen Trennungsgang durchzuführen.
-
Nachweis von Ammonium-Ionen.
-
Nachweis von Carbonat-Ionen
Suche nach passenden Schlagwörtern
- Fällungsreaktion
- Analyseverfahren
- Farbreaktionen
- Spektroskopie
- Chlorid-Ionen
- Hydroxid-Ionen
- Säure-Base-Titration
- Iodid-Ionen
- Sulfat-Ionen
- quantitative Elementaranalyse
- Sulfid-Ionen
- Ammonium-Ionen
- Bromid-Ionen
- Flammenfärbung
- Wasserstoff-Ionen
- Carbonat-Ionen
- Qualitative Elementaranalyse
- Farbindikatoren

