Energie bei chemischen Reaktionen
Bei einer chemischen Reaktion laufen Stoff- und Energieumwandlungen gleichzeitig ab. Dabei kann Energie aufgenommen (endotherm) oder abgegeben (exotherm) werden. Damit Stoffe miteinander reagieren können, müssen diese vorher durch Zufuhr von Aktivierungsenergie aktiviert werden.
Energieumwandlungen bei chemischen Reaktionen
Jede chemische Reaktion ist mit Energieumwandlungen verbunden. So wird z. B. beim Verbrennen von Holz die im Holz gespeicherte chemische Energie in thermische Energie und Lichtenergie umgewandelt, die in Form von Wärme und Licht an die Umgebung abgegeben werden. Zugleich sind chemische Reaktionen auch mit Stoffumwandlungen verbunden. Die Verbrennung erfolgt unter Verbrauch von Sauerstoff, wobei hauptsächlich Kohlenstoffdioxid und Wasser entstehen.
Bei der chemischen Reaktion zur Zerlegung des Wassers und auch bei der zur Bildung von Wasser sind z. B. energetische Erscheinungen zu beobachten. Die Zerlegung des Wassers ist nur bei ständiger Energiezufuhr möglich. Es wandelt sich die elektrische Energie in chemische Energie der Stoffe Wasserstoff und Sauerstoff um. Sobald der elektrische Strom ausgeschaltet wird, hört die Bildung von Wasserstoff und Sauerstoff – also die chemische Reaktion – auf.
Die Synthese des Wassers ist mit einer Umwandlung der chemischen Energie des Wasserstoffs und Sauerstoffs in thermische Energie und Lichtenergie verbunden. Einmal durch die Zündung in Gang gebracht, wird Wasser gebildet, solange Wasserstoff und Sauerstoff zur Verfügung stehen (Knallgasreaktion).
Chemische Reaktionen sind immer mit Energieumwandlungen verbunden. Bei chemischen Reaktionen wird chemische Energie der Ausgangsstoffe in thermische Energie, Lichtenergie, elektrische oder mechanische Energie umgewandelt und als Wärme, Licht, Elektroenergie oder mechanische Arbeit abgegeben oder umgekehrt.
Je nachdem, ob insgesamt bei einer Reaktion thermische Energie als Wärme zugeführt werden muss oder abgegeben wird, unterscheidet man exotherme Reaktionen (ex = nach außen, therm= Wärme) und endotherme Reaktionen (endo = nach innen).
-
Das Abbrennen einer Wunderkerze ist eine exotherme Reaktion.

Heinz Mahler, Berlin
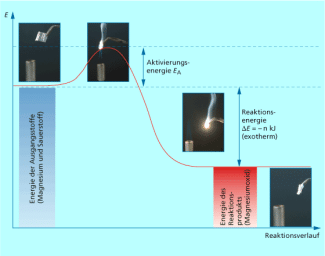
Aktivierungsenergie
Viele chemische Reaktionen laufen bei Raumtemperatur nicht ab, obwohl es möglich sein sollte. Bringt man Wasserstoff und Sauerstoff zusammen, reagieren sie nicht spontan unter Bildung von Wasser. Eine Kerze beginnt nicht von allein zu brennen. Magnesium reagiert nicht spontan mit Sauerstoff. Wenn ein Magnesiumspan allerdings in die Brennerflamme gehalten wird, fängt er nach kurzer Zeit an mit greller Lichterscheinung zu brennen. Nimmt man den Span aus der Flamme, brennt der Magnesiumspan weiter.
Durch die Energie der Brennerflamme wird die Entzündungstemperatur von Magnesium erreicht. Die Ausgangsstoffe werden reaktionsbereit (= aktiv) gemacht.
Die Aktivierungsenergie ist der Energiebetrag, der notwendig ist, um eine chemische Reaktion starten zu können.
Danach läuft die Reaktion zwischen Magnesium und Sauerstoff ohne Energiezufuhr ab. Im Gegenteil, eine grelle Lichterscheinung (Abgabe von Lichtenergie) und eine starke Wärmeabgabe sind zu erkennen (siehe Bild 2). Die Wärmeabgabe ist zum dauerhaften Überschreiten der Entzündungstemperatur von Magnesium völlig ausreichend.
Analog wird ein Gemisch aus Wasserstoff und Sauerstoff durch einen Funken zur Reaktion gebracht.
Wie groß die Aktivierungsenergie ist, hängt von den Reaktionspartnern und den gegebenen Bedingungen ab. Nicht immer kann oder muss die Aktivierungsenergie als Wärme zugeführt werden. Sie kann auch als Licht oder in Form mechanischer Arbeit die chemische Reaktion auslösen.
Bei Knallplätzchen beispielsweise wird die chemische Reaktion, die zum Knall führt, durch mechanische Energie aktiviert.
Manchmal reicht die in der Umwelt vorhandene thermische Energie als Aktivierungsenergie aus.
Das Rosten von Eisen an der Luft und das Aushärten eines Zement-Kies-Wasser-Gemischs zu Beton sind solche Reaktionen.
-
Bei chemischen Reaktionen sind Stoffumwandlungen immer mit Energieumwandlungen verbunden,z. B. Verbrennung von Magnesium.
Heinz Mahler - H. Mahler, Fotograf, Berlin
Exotherme chemische Reaktionen
Stoffumwandlungen, bei denen thermische Energie in Form von Wärme abgegeben wird, nennt man exotherme chemische Reaktionen. Es wird dabei Energie freigesetzt, die z. B. genutzt werden kann, um Wärme und Licht abzugeben oder um elektrische bzw. mechanische Arbeit zu verrichten.Die Reaktionsprodukte haben einen geringeren Energiegehalt als die Ausgangsstoffe. Die Reaktionswärme Q erhält ein negatives Vorzeichen.
Typische exotherme Reaktionen sind z. B. das Verbrennen von Benzin im Zylinder eines Motors oder das Verbrennen von Kohle in einem Ofen. Für alle diese Reaktionen gilt: Die in den Ausgangsstoffen gespeicherte Energie ist größer als die in den Reaktionsprodukten enthaltene Energie. Diese Energiedifferenz wird auch als Reaktionswärme bezeichnet.
-
Bei einer exothermen Reaktion ist die chemische Energie der Reaktionsprodukte kleiner als die der Ausgangsstoffe.

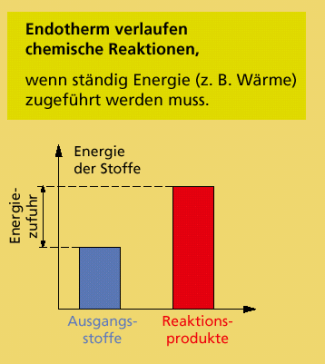
Endotherme chemische Reaktionen
Stoffumwandlungen, die nur erfolgen, wenn Energie in Form von Wärme zugeführt wird, nennt an endotherme chemische Reaktionen. Die Reaktionsprodukte haben einen höheren Energiegehalt als die Ausgangsstoffe. Die Reaktionswärme Q erhält ein positives Vorzeichen.
Ein Beispiel für eine solche endotherme Reaktion ist die Entstehung von Stickstoffmonooxid aus Stickstoff und Sauerstoff. Diese Reaktion „verbraucht“ Wärme. Die Elektrolyse von Wasser zu Sauerstoff und Wasserstoff ist ebenfalls eine endotherme Reaktion. Für alle endothermen Reaktionen gilt: Die in den Reaktionsprodukten enthaltene Energie ist größer als die in den Ausgangsstoffen vorhandene Energie.
-
Bei einer endothermen Reaktion ist die chemische Energie der Produkte größer als die der Ausgangsstoffe.