Erster Hauptsatz der Thermodynamik
Der 1. Hauptsatz der Thermodynamik ist der Energieerhaltungssatz, formuliert für thermodynamische Prozesse. Die heute bekannte mathematische Formulierung des 1. Hauptsatzes der Thermodynamik stammt von RUDOLF CLAUSIUS und wurde von ihm um 1850 so formuliert:
Die einem thermodynamischen System zugeführte Wärme ist gleich der Summe aus der Änderung der inneren Energie des Systems und der von ihm verrichteten mechanischen Arbeit.
Eine andere übliche Formulierung des 1. Hauptsatzes der Thermodynamik lautet:
Es ist unmöglich, eine Perpetuum mobile 1. Art zu konstruieren.
Erster Hauptsatz der Thermodynamik
Die Hauptsätze der Thermodynamik sind grundlegende Erfahrungssätze, die aus zahlreichen Beobachtungen und Messungen gewonnen wurden. Der Begriff „Hauptsatz“ ist ein historischer Begriff, der die fundamentale Bedeutung dieser Gesetze für die gesamte Physik hervorragend charakterisiert. Verknüpfen doch die Hauptsätze der Thermodynamik die verschiedenen Teilgebiete der Physik miteinander und haben trotz aller Umbrüche in der Physik an ihrer generellen Gültigkeit nichts eingebüßt.
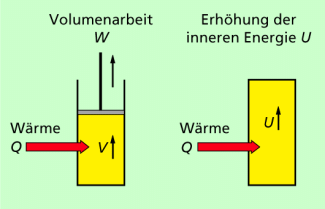
Der 1. Hauptsatz der Thermodynamik ist der Energieerhaltungssatz für thermodynamische Prozesse (Bild 1). Das Prinzip von der Erhaltung der Energie (Energieerhaltungssatz) wurde erstmals von J. R. MAYER 1842 und etwas später H. V. HELMHOLTZ 1847 angegeben. Die heute bekannte mathematische Formulierung des 1. Hauptsatzes der Thermodynamik stammt von RUDOLF CLAUSIUS (1822-1888) und wurde von ihm um 1850 folgendermaßen formuliert:
Die einem thermodynamischen System zugeführte Wärme ist gleich der Summe aus der Änderung der inneren Energie des Systems und der von ihm verrichteten mechanischen Arbeit.
Für die Vorzeichen gilt dabei folgende allgemein übliche Festlegung:
- Die am System verrichtete Arbeit bzw. die zugeführte Wärme ist positiv. Die innere Energie wird dabei größer.
- Die vom System verrichtete Arbeit bzw. die abgegebene Wärme ist negativ. Die innere Energie wird dabei kleiner.
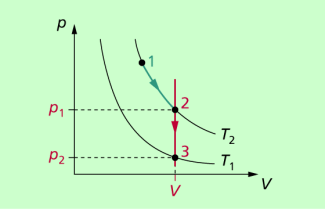
Da der 1. Hauptsatz eine Bilanzgleichung ist, gilt er auch in umgekehrter Richtung, d.h. wird an einem System mechanische Arbeit verrichtet, so ist diese gleich der Summe aus der Änderung der inneren Energie und der vom System abgegebenen Wärme. Ein anderer möglicher Prozess, bestehend aus einer isothermen Expansion und einer isochoren Verkleinerung des Druckes bei Verkleinerung der Temperatur, ist in Bild 2 dargestellt.
Der „Vermittler“ zwischen zugeführter Wärme und verrichteter mechanischer Arbeit ist die von Clausius eingeführte Zustandsgröße innere Energie.
Die innere Energie ist die Gesamtenergie aller Teilchen (Atome, Moleküle) eines Körpers, d.h. die Summe der Bewegungsenergien (Translation-, Rotation- und Schwingungsenergien), der potenziellen Energien sowie der Bindungsenergien. Nähere Erläuterungen zu dieser Größe sind unter dem Stichwort „innere Energie“ zu finden.
Bedeutung des 1. Hauptsatzes
Mithilfe des ersten Hauptsatzes ist es möglich, Energiebilanzen für die verschiedenen thermischen Prozesse (isotherme, isochore, isobare und adiabatische Zustandsänderungen) aufzustellen. Nähere Erläuterungen dazu sind bei den einzelnen Zustandsänderungen gegeben. Er ist auch eine entscheidende Grundlage für das Verständnis der Wirkungsweise von Wärmekraftmaschinen.
Die Bedeutung des 1. Hauptsatzes der Thermodynamik und des daraus abgeleiteten allgemeinen Prinzips von der Erhaltung der Energie geht aber weit über die Physik hinaus. Es ist heute ein Grundprinzip in allen Naturwissenschaften und fundamental für alle technischen Entwicklungen. Ist doch die Frage nach dem Wirkungsgrad einer Maschine oder eines technischen Verfahrens heute oft von entscheidender Bedeutung.
Trotz aller Bemühungen zur Verbesserung des Wirkungsgrades ist es bisher nicht gelungen, eine Maschine oder eine Vorrichtung zu bauen, die fortwährend Arbeit verrichtet, ohne dass Energie in irgendeiner Form zugeführt wird. Das Bestreben, eine solche Maschine, ein Perpetuum mobile, zu konstruieren, ist uralt. Die Vermutung dass dies unmöglich ist, führte schon 1775, mehr als 100 Jahre vor der Formulierung des Prinzips von der Energieerhaltung, zu dem Beschluss der Pariser Akademie der Wissenschaften und der Royal Society in London, keine Begutachtungen von Konstruktionen eines Perpetuum mobile mehr vorzunehmen.
Eine heute übliche Formulierung des 1. Hauptsatzes der Thermodynamik ist daher auch die über ein Perpetuum mobile:
Es ist unmöglich, eine Perpetuum mobile 1. Art zu konstruieren.
Die Bezeichnung 1. Art bezieht sich dabei auf Vorrichtungen, die im Sinne des 1. Hauptsatzes mehr äußere Arbeit verrichten als ihnen Energie zugeführt wird. Sie sind von einem Perpetuum mobile 2. Art zu unterscheiden. Nähere Erläuterungen zum Perpetuum mobile sind unter diesem Stichwort zu finden.