Isobare Zustandsänderungen
Bei einer isobaren Zustandsänderung eines Gases bleibt der Druck konstant. Die Zustandskurve im p-V-Diagramm ist eine Parallele zur V-Achse. Ein solcher Prozess kann realisiert werden, wenn dem Gas eine Wärme Q zugeführt wird. Damit dabei der Druck konstant bleibt, muss von dem Gas gleichzeitig Volumenarbeit verrichtet werden. Die zugeführte Wärme Q erzeugt bei einer isobaren Zustandsänderung eine Änderung der inneren Energie und des Volumens. Nach dem 1. Hauptsatz der Thermodynamik ergibt sich die Bilanz:
Bei Verwendung des Modells des idealen Gases erhöht die zugeführte Wärme Q die innere Energie U des Gases und verrichtet Volumenarbeit.
Die Zustandsgleichung für Gase gibt die Beziehungen zwischen den thermischen Zustandsgrößen Druck, Temperatur und Volumen an. In vielen Fällen kann bei der Untersuchung thermodynamischer Prozesse zur Vereinfachung eine oder auch mehrere Zustandsgrößen als konstant angenommen werden.
Bei isobaren Zustandsänderungen eines Gases bleibt der Druck konstant.
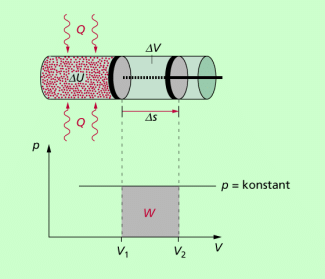
Die Zustandskurve im p-V-Diagramm ist eine Parallele zur V-Achse (Bild 1). Ein solcher Prozess wird realisiert, wenn einem eingeschlossenen Gas eine Wärme Q von außen zugeführt wird und sich das Volumen so erhöht, dass der Druck konstant bleibt.
Die zugeführte Wärme Q erhöht die Temperatur des eingeschlossenen Gases und damit seine innere Energie U. Mit dem Ansteigen der Temperatur erhöht sich die kinetische Energie der Gasteilchen, was zu einem Druckanstieg führen würde. Um aber einen isobaren Prozess (p = konstant) zu realisieren, muss daher von dem Gas gleichzeitig Volumenarbeit verrichtet werden. Durch die Vergrößerung des Volumens wird der Druck konstant gehalten.
Quantitative Zusammenhänge
Bei konstantem Druck gilt für den Zusammenhang zwischen Volumen und Temperatur:
Die zugeführte Wärme Q erzeugt bei einer isobaren Zustandsänderung eine Änderung der inneren Energie und des Volumens. Nach dem 1. Hauptsatz der Thermodynamik ergibt sich die Bilanz:
Bei Verwendung des Modells ideales Gas kann die Volumenarbeit W, die das Gas zur Vergrößerung des Volumens um verrichtet, berechnet werden. Die Zustandsgleichung im Ausgangszustand ist:
Nach Zuführung der Wärme Q erhöht sich die Temperatur des Gases
Die Zustandsgleichung im Endzustand nach Aufnahme der Wärme Q ist daher:
Die vom Gas verrichtete Volumenarbeit ist damit:
In analoger Weise kann auch die Änderung der inneren Energie des idealen Gases berechnet werden (siehe dazu den Beitrag „Isochore Zustandsänderungen“). Bei einer Erhöhung der Temperatur um ist die Änderung der inneren Energie eines idealen Gases:
Aus dem 1. Hauptsatzes kann damit die Wärme bestimmt werden, die für eine Temperaturerhöhung um des idealen Gases bei einer isobaren Prozessführung notwendig ist:
Die Teilchenanzahl N kann durch die Stoffmenge n und die universelle Gaskonstante R ersetzt werden. Aus
ergibt sich für die Wärme:
Die Größe , die molare Wärmekapazität bei konstantem Druck, ist für alle einatomigen Gase konstant. Sie hat einen Wert von:
Für zweiatomige Gase müssen bei der Berechnung der molaren Wärmekapazität neben den Freiheitsgraden der Translation auch zwei Freiheitsgrade der Rotation berücksichtigt werden, da sich die kinetische Energie der Teilchen gleichmäßig auf alle Freiheitsgrade verteilt (Gleichverteilungssatz)
Aus der molaren Wärmekapazität können auch theoretische Werte der spezifischen Wärmekapazitäten bei konstantem Druck einzelner Gase leicht bestimmt werden. Für das einatomige Helium ergibt sich z.B.:
Diese theoretisch berechneten Werte, stimmen mit den experimentell ermittelten Werten gut überein.
Durch die Einführung der spezifischen Wärmekapazität können die molaren und die molekularen Größen ersetzt werden durch direkt messbare Größen. Für die Wärme, die für eine Temperaturerhöhung eines einatomigen Gases bei einer isobaren Prozessführung notwendig ist, ergibt sich mit der spezifischen Wärmekapazität bei konstantem Druck:
Suche nach passenden Schlagwörtern
- isobare Zustandsänderungen
- innere Energie
- Berechnung
- 1. Hauptsatz der Thermodynamik
- Gleichverteilungssatz
- spezifische Wärmekapazität bei konstantem Druck
- Isobare
- isobarer Prozess
- Wärme
- Volumenarbeit
- Temperatur
- Druck
- Freiheitsgrad
- molare Wärmekapazität
- Simulation
- p-V-Diagramm
- Rechenbeispiel
- ideales Gas
- Volumen