Enzyme
Enzyme sind hochmolekulare Eiweißkörper, die als Biokatalysatoren an fast allen Stoffwechselreaktionen in tierischen sowie pflanzlichen Organismen beteiligt sind. Sie sind in der Lage, die für jede Reaktion notwendige Aktivierungsenergie (Höhe der Energiebarriere) herabzusetzen.
Neben der Primärstruktur von Enzymen haben besonders die Sekundärstruktur (Faltung) und Tertiärstruktur (räumliche Struktur) eine besondere Bedeutung für die Aktivität und Substratspezifität von Enzymen.
Die Enzymforschung ermöglicht nicht nur ein Verständnis über die Wirkung von Enzymen, sondern auch ihre Nutzung.
Enzyme sind hochmolekulare Eiweißkörper (Proteine oder Proteide), die als Biokatalysatoren an fast allen Stoffwechselreaktionen in tierischen sowie pflanzlichen Organismen beteiligt sind.
Katalysatoren ermöglichen oder beschleunigen Reaktionen durch die Herabsetzung der Aktivierungsenergie (Energie, die benötigt wird, um die Teilchen in einen aktiven Zustand zu versetzen).
So sind Enzyme in der Lage, die für jede Reaktion notwendige Aktivierungsenergie bei biochemischen Reaktionen herabzusetzen. Das ist u.a. wichtig, da im Organismus die Temperatur einen bestimmten Grenzwert nicht überschreiten darf, weil es sonst zu Schädigungen kommt. Durch den Einfluss der Enzyme können unter physiologischen Bedingungen sehr langsam ablaufende Reaktionen beschleunigt werden. Enzyme können die Reaktionsgeschwindigkeit um den Faktor 1000 bis 1000000 beschleunigen.
Im Allgemeinen handelt es sich bei den biochemischen Reaktionen um Gleichgewichtsreaktionen. Enzyme beschleunigen die Geschwindigkeit mit der das chemische Gleichgewicht eingestellt wird. Sie beeinflussen aber die Lage des chemischen Gleichgewichtes nicht.
-
Wirkungsweise der Enzyme
Ein Beispiel für die Effektivität von Biokatalysatoren ist die Reduktion von Luftstickstoff. In der Natur (Bedingungen: 20 °C, 1 bar) setzen Bakterien mithilfe ihrer Enzyme die reaktionsträgen Stickstoffmoleküle () mit Wasserstoff zu Ammonium-Ionen um. Neben einigen im Boden lebenden Bakterien verfügen die symbiotisch in den Wurzeln der Schmetterlingsblütengewächsen lebenden so gennanten Knöllchenbakterien über die entsprechenden Enzyme (Nitrogenase). Im HABER-BOSCH-Verfahren zur Ammoniaksynthese läuft dieser Prozess analog ab. Dafür sind aber drastischere Bedingungen (trotz Katalysator 250 °C, 300 bar) nötig.
Der Aufbau von Enzymen
Enzyme sind einfache Eiweiße (Proteine) oder Eiweißstoffe mit einem Nichtprotein-Anteil (Proteide). Demzufolge wird die Biosynthese (Synthese im Organismus) auch durch die entsprechenden Gene gesteuert.
Enzyme können aus einer oder mehreren Peptidketten zusammengesetzt sein. Die Enzyme des Verdauungstraktes z.B. sind Enzyme, die nur aus einer Peptidkette bestehen. Dagegen sind die meisten in den Zellen vorkommenden Enzyme (zelluläre Enzyme) aus mehreren, verschiedenen Peptidketten aufgebaut. Diese Peptidketten sind durch die Art, Anzahl und Reihenfolge der verknüpften Aminosäurereste (Primärstruktur) gekennzeichnet.
Neben der Primärstruktur von Enzymen haben besonders die Sekundärstruktur (Faltung) und Tertiärstruktur (räumliche Struktur) eine Bedeutung für den Wirkmechanismus von Enzymen, da sie die in der Primärstruktur weit entfernt liegenden Aminosäuren in räumliche Nähe bringen können. Diese räumliche Nähe ist wichtig, denn dadurch wird das sogenannten aktive Zentrum ausgebildet (s.u.).
Unter der Quartärstruktur von Enzymen versteht man die räumliche Anordnung der einzelnen Enzyme in z.B. einem Multienzymkomplex. Dazu gehört besonders bei den Proteiden (Apoenzyme), der Nichtprotein-Anteil, das sogenannte Coenzym. Beide Teile können fest aneinander gebunden sein, oder nur vorübergehend beispielsweise durch die Ausbildung von Wasserstoffbrückenbindungen miteinander verknüpft.
Handelt es sich beim Nichtprotein-Anteil um komplex gebundene Metall-Ionen (Spurenelemente), so spricht man häufig von Cofaktoren anstelle von Coenzymen. Die Bindungen, die dann zum Apoenzym ausgebildet werden, sind Komplexbindungen. Als Metalle treten vor allem Eisen (Hämoglobin), Magnesium (Chlorophyll), Kupfer (Enzyme der Atmungskette) und Mangan oder Zink (DNA-Polymerasen) auf.
Erst die voll ausgebildeten Enzyme (Apoenzym und Coenzym bzw. Cofaktor) erreichen die biologische Wirksamkeit.
Die Enzyme werden in 6 Hauptklassen eingeteilt. Diese unterscheiden sich in ihrer Wirkungsspezifität.
- Oxidoreduktasen katalysieren Oxidationen und Reduktionen.
- Transferasen katalysieren die Übertragung von funktionellen Gruppen (z.B. Aldehyd-, Amino- und Glycosylgruppen).
- Hydrolasen sind hydrolytisch spaltende Enzyme (z.B. Ester-, Peptid- und Glycosidspaltungen).
- Lyasen katalysieren die Spaltung von C-C-; C-O-; C-N- und C-S-Bindungen (z.B. Dehydratasen, Decarboxylasen).
- Isomerasen katalysieren die Umwandlung in andere Isomere.
- Ligasen katalysieren den Aufbau neuer C-C-; C-O-; C-N- und C-S-Bindungen (z.B. Carboxylasen, Synthetasen).
Chymotrypsin ist beispielsweise ein Enzym der Bauspeicheldrüse, dessen Funktionsweise vollständig aufgeklärt wurde. Es katalysiert die Spaltung einer Peptidbindung. Diese im Darm stattfindende Reaktion erlaubt die Spaltung von Eiweißen, die mit der Nahrung aufgenommen wurden, in Aminosäuren, die vom Blut aufgenommen werden können. Chymotrypsin gehört somit zu den Hydrolasen.
Wirkungsmechanismus
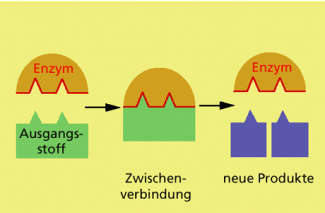
Das sogenannte aktive Zentrum des Enzyms hat eine bestimmte Form, in die das Substrat, das beeinflusst wird, genau hineinpasst wie ein Schlüssel in das zugehörige Schloss (Schoss-Schlüssel-Prinzip). Daher bindet das aktive Zentrum des Enzyms aus der Vielzahl der in der Zelle vorkommenden Substrate nur ein ganz bestimmtes Substrat. Diese Selektivität wir auch Substratspezifität genannt.
Durch die Ausbildung des Enzym-Substrat-Komplexes werden bestimmte Reaktionen ermöglicht. Nach Ablauf der Reaktionen zerfällt der Enzym-Produkt-Komplex. Das Enzym kann dann erneut eine Umsetzung katalysieren.
Durch mehrere aufeinanderfolgende enzymkatalysierte (Teil)-Reaktionen kann auch die Gesamtausbeute der (Gesamt)-Reaktion positiv verändert werden. Das geschieht dann, wenn das Reaktionsprodukt der einen Reaktion sofort an das nächste Enzym gebunden und umgesetzt wird. Dadurch ist die Konzentration der Zwischenprodukte sehr gering. Sie werden nämlich der Teilreaktion sofort entzogen. Das regt die Neubildung von Reaktionsprodukten an und unterdrückt ihren Zerfall.
Im Ergebnis erfolgt, auf die Gesamtreaktion bezogen, ein fast vollständiger Stoffumsatz.
Die notwendige Energie für diese Prozesse liefert die Umwandlung von ATP zu ADP.
Nutzung von Enzymen
Da Enzyme an nahezu allen Stoffwechselreaktionen in tierischen sowie pflanzlichen Organismen beteiligt sind, kann an dieser Stelle nur auf ausgewählte Beispiele eingegangen werden.
Die Enzymforschung ist heute eines der Hauptgebiete der Biochemie, der Biotechnologie und z.T. auch der Gentechnologie. Einsatzgebiete für die Enzymtechnologie sind die Pharma-, Getränke-, Lebensmittel- und Waschmittelindustrie, um nur einige zu nennen. Dabei werden technisch jene Vorzüge der Enzyme genutzt, die bei komplizierten, chemisch aufwendige Reaktionen eine hohe Ausbeute und wenig Nebenprodukte und milde Reaktionsbedingungen bewirken.
In der Medizin wird speziell die Aufklärung von Enzymmustern zur Diagnose und Therapiekontrolle herangezogen. Bei einem Herzinfarkt beispielsweise ändert sich das Enzymmuster des Blutes auf charakteristische Weise und ermöglicht somit eine schnelle und sichere Diagnose.
Immer mehr werden die Enzyme auch zur Bestimmung verschiedener Stoffe, wie z.B. Hormonen (Schwangerschaftstest), Antigenen und Drogen eingesetzt.

