Ester
Die Ester sind wichtige Derivate der Carbonsäuren. Sie treten in einer sehr großen Vielzahl und Vielfältigkeit auf. Die typische Reaktion zu ihrer Bildung nennt man Veresterung. Eine sehr große Rolle spielen die Ester in der Natur. Sie sind in allen Lebewesen in den unterschiedlichsten Erscheinungsformen zu finden, z. B. als Riechstoffe, Fette, Zellmembranbaustein.
Bildung und Spaltung von Estern
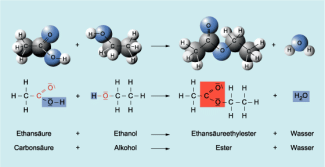
Ester gehören zu einer großen, vielfältigen Stoffklasse. Trotz der Vielfalt weisen die Stoffe eine Gemeinsamkeit auf. Sie gehen aus speziellen Reaktionen von Säuren mit Alkoholen hervor. Carbonsäureester bilden eine Gruppe von Estern, die entstehen, wenn Carbonsäuren mit Alkoholen reagieren. Wie bei allen anderen Estern sind auch diese Stoffe durch eine besondere funktionelle Gruppe gekennzeichnet, durch die Estergruppe. Die allgemeine Formel der Carbonsäureester lautet R1COOR2.
Die entscheidende strukturelle Voraussetzung für Reaktionen von Carbonsäuren mit Alkoholen bilden die Carboxylgruppe, z. B. der Alkansäuren, und die Hydroxylgruppe der alkohole. Bei dem chemischen Prozess werden aus den funktionellen Gruppen der Carbonsäuren und der Alkohole Atome und Atomgruppen abgespalten und lagern sich zu Wassermolekülen zusammen. Zwischen den Molekülresten der Carbonsäure und des Alkohols bildet sich die Estergruppe heraus.
Diese chemische Reaktion nennt man Veresterung.
Säure + Alkohol → Ester + Wasser
Es handelt sich um eine Substitutionsreaktion. Diese besondere Form, bei der zwei Moleküle unter Austritt eines kleinen Moleküls zu einem größeren zusammentreten, nennt man Kondensation. Der Name der sich bildenden Ester wird aus dem Namen der Säure, gefolgt vom Alkylrest des Alkohols und der Bezeichnung -ester gebildet.
-
Beispielreaktion für die Bildung eines Esters aus einer Carbonsäure und einem Alkohol
Eigenschaften von Estern
Auch bei den Estern bestimmt die Struktur die Eigenschaften. Die Estergruppe ist zwar schwach polar, aber die Alkylgruppen im Estermolekül sind unpolar. Dadurch lösen sich Ester schlecht in Wasser. Da in den Molekülen der Ester, anders als in den Molekülen der Ausgangsstoffe, keine stark polaren Gruppen vorliegen, können Estermoleküle untereinander keine Wasserstoffbrücken ausbilden.
Zwischen den Molekülen wirken nur schwache zwischenmolekulare Kräfte. Daraus ergibt sich die hohe Flüchtigkeit insbesondere der Ester der kurzkettigen Alkansäuren und Alkohole.
Die Siedetemperatur der Ester ist teilweise sogar niedriger als die des entsprechenden Alkohols, obwohl die Molekülmasse des Esters viel größer ist (s. Tabelle).
Unabhängig davon nimmt die Siedetemperatur der Carbonsäureester im Allgemeinen mit steigender Molekülmasse zu.
Siedetemperaturen im Vergleich | |
Stoff | Siedetemperatur |
| Methanol | 64,5 °C |
| Methansäure | 101 °C |
| Methansäuremethylester | 31,5 °C |
| Ethanol | 78,3 °C |
| Ethansäure | 117,9 °C |
| Ethansäureethylester | 77,1 °C |
| Propan-1-ol | 97,2 °C |
| Propansäure | 140,8 °C |
| Propansäureethylester | 99,3 °C |
| Butan-1-ol | 117,7°C |
| Butansäure | 163,3°C |
| Butansäureethylester | 120 °C |
Ester in der Natur und im täglichen Leben
Wir sind uns dessen zwar nicht bewusst, aber Ester begegnen uns im täglichen Leben ständig. Die Palette ihrer Einsatzmöglichkeiten ist sehr vielfältig. Viele Duft- und Aromastoffe gehören zu dieser Stoffklasse. Einige kommen beispielsweise in Früchten natürlich vor, andere stellt man künstlich her und setzt sie z. B. Nahrungsmitteln zu. Ethansäureethylester findet Verwendung als Lösemittel und riecht klebstoffartig.
Einige Bestandteile moderner Waschmittel gehören ebenfalls in die Gruppe der Ester.
In der Natur sind die Ester langkettiger Carbonsäuren und langkettiger Alkohole von Bedeutung, die als Wachse bezeichnet werden und den Verdunstungsschutz auf Pflanzenblättern, -nadeln und Früchten bilden.
Besonders wichtig und bekannt sind Ester des Glycerols – sie bilden die Fette.
Bedeutsam sind auch recht kompliziert gebaute Ester der Phosphorsäure: ATP und ADP sind im Organismus für den Energiestoffwechsel unverzichtbar. In Form von ATP wird die in den Zellen benötigte Energie bereitgestellt.
Beispiele:
Der verführerische Duft von Früchten ist ein Gemisch von bis zu 20 verschiedenen Verbindungen, darunter sind viele Ester von kurzkettigen Alkansäuren.
Am Apfelaroma sind u. a. folgende Ester beteiligt: 2-Methylbuttersäureethylester, Buttersäureethylester, Buttersäurehexylester, Essigsäurehexylester.
Bei Birnen gehören der Methyl- und Ethylester der 2,4-Decadienäure sowie der Pentyl- und der Hexylester der Ethansäure zu den Aroma bestimmenden Verbindungen.
Der ringförmige Alkohol Menthol sowie der Mentholester der Ethansäure sind hauptverantwortlich für das Aroma der Pfefferminze.
Die Fette sind ebenfalls Ester. Es handelt sich um Ester des dreiwertigen Alkohols Glycerol (Propan -1,2,3-triol) mit den sogenannten Fettsäuren.
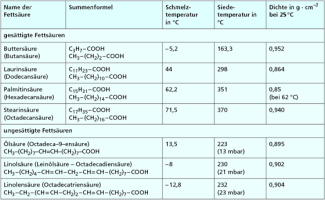
Fettsäuren sind unverzweigte organische Säuren mit einer Carboxylgruppe, die eine geradzahlige Anzahl an C-Atomen (oft 12 bis 20, Ausnahme Butansäure) aufweisen. Im Alkylrest der gesättigten Fettsäuren existieren zwischen den Kohlenstoffatomen nur Einfachbindungen.
Die ungesättigten Fettsäuren enthalten in der Kohlenstoffkette entweder eine (einfach ungesättigte) oder mehrere Doppelbindungen (mehrfach ungesättigt). Besonders ungesättigte Fettsäuren sind für die Ernährung von Bedeutung, weil der menschliche Körper sie nicht selbst aufbauen kann. Man bezeichnet sie als essenzielle Fettsäuren (unentbehrliche Fettsäuren). Fehlen die Fettsäuren, so treten Mangelerscheinungen beim Menschen auf.
-
Fettsäuren
Ester in Medizin und Haushalt
Auch bei dem Schmerzmittel Aspirin® handelt es sich um einen Ester. Aspirin® ist wohl jedem bekannt. Der enhaltene Wirkstoff – Acetylsalicylsäure (ASS) – wurde 1897 von FELIX HOFFMANN (1868-1946) als Schmerz- und Rheumamittel synthetisiert.
Acetylsalicylsäure ist eine Verbindung aus Salicylsäure und Ethansäure (Essigsäure). Bei der möglichen Umsetzung beider Stoffe reagiert die Salicylsäure aufgrund ihrer Hydroxylgruppe wie ein Alkohol. Ihre Carboxylgruppe bleibt unverändert. Das Molekül der Acetylsalicylsäure enthält deshalb neben der Estergruppe eine Carboxylgruppe. Der Synthesevorschlag entspricht einer gewöhnlichen Esterkondensation, die Rückreaktion der Esterhydrolyse.
Es gibt aber nicht nur Ester von organischen Säuren, auch anorganische Säuren wie Salpetersäure, Schwefelsäure oder Phosphorsäure bilden Ester, die im täglichen Leben eine große Rolle spielen.
Ester der Schwefelsäure mit Alkoholen im Kettenlängenbereich von 12 bis 18 Kohlenstoffatomen (Fettalkohole) sind als sogenannte Alkylsulfate in modernen Wasch- und Reinigungsmitteln enthalten. Im Gegensatz zu den alkalisch reagierenden Seifen sind sie neutral und damit hautfreundlicher.
Ester der Salpetersäure (organische Nitrate) sind fast ausschließlich als Sprengstoffe bekannt. Nitroglycerin (Glyceroltrinitrat) ist ein Salpetersäureester des Glycerols. Die ölige Flüssigkeit explodiert bereits, wenn ein Tropfen auf eine harte Unterlage fällt oder wenn sie geringfügig erhitzt wird. Deswegen saugt man Nitroglycerin mit Kieselgur auf. Das erhaltene Gemisch lässt sich weitaus gefahrloser handhaben und ist unter dem Namen Dynamit bekannt. Dynamit wurde vom schwedischen Chemiker ALFRED NOBEL (1833-1896) entdeckt.
Der Salpetersäureester der Cellulose, das Cellulosenitrat, findet ebenfalls als Sprengstoff Verwendung. Große Bedeutung haben auch die Ester der Phosphorsäure (organische Phosphate), die außerordentlich vielfältig sind. Einige dieser Ester wie Adenosintriphosphat (ATP) oder Lecithin sind wichtige Verbindungen in fast allen lebenden Organismen und an vielen biologischen Prozessen beteiligt.
In der Technik dienen Phosphorsäureester z. B. als Putz- und Reinigungsmittel oder als Weichmacher für Kunststoffe. Auch als flammen- oder korrosionshemmende Grundierung für Lackierungen von Metallen werden diese Ester anorganischer Säuren eingesetzt.
Besonders traurigen Ruhm erreichten extrem giftige Phosphorsäureester, die deutsche Chemiker während des 2. Weltkriegs entwickelten. Eingesetzt wurden diese chemischen Kampfstoffe (z. B. Sarin, Tabun) vom irakischen Diktator SADDAM HUSSEIN (1937-2006) gegen aufständische Kurden und im Krieg gegen den benachbarten Iran.
Auch unter den Kunststoffen finden wir Ester. Durch Polykondensation der Terephthalsäure (Benzen-1,4-Dicarbonsäure) mit Ethan-1,2-diol erhält man den Kunststoff Polyethylenterephthalat (PET), aus dem nicht nur Getränkeflaschen hergestellt werden. Polyesterfasern aus den gleichen Rohstoffen für Hemden, Blusen und Gardinen sind zudem die meist produzierten Synthesefasern. Schließlich ist auch Polycarbonat, aus dem diese CD gefertigt ist, ein Ester.

