Grundlagen von Reaktionen
Chemische Reaktionen sind Vorgänge, bei denen neue Stoffe mit neuen Eigenschaften entstehen. Es erfolgt eine Stoffumwandlung durch Umordnung von Teilchen und chemischen Bindungen.
Gleichzeitig sind chemische Reaktionen immer mit Energieumwandlungen verbunden.
Chemische Reaktionen können mit Wortgleichungen oder Formelgleichungen beschrieben werden.
Physikalische Vorgänge
Führt man dem Wasser Wärme zu, so siedet es bei einer Temperatur von 100 °C. Es entsteht Wasserdampf. Kühlt man den Wasserdampf unter die Siedetemperatur ab, so entsteht wieder flüssiges Wasser mit denselben Eigenschaften wie vorher.
Durch das Sieden hat sich nur der Aggregatzustand des Stoffes Wasser geändert. Es entstand aber kein neuer Stoff. In einem Destillationsapparat kann man diese Vorgänge beobachten.
Durch Erhitzen können die Eigenschaften des Wassers nicht bleibend verändert werden.
Stellt man Wasser längere Zeit in einen Gefrierschrank, so entsteht Eis. Bei Zimmertemperatur wird aus dem Eis bald wieder Wasser mit den bekannten Eigenschaften. Durch Abkühlen können die Eigenschaften des Wassers auch nicht bleibend geändert werden.
Durch physikalische Vorgänge wie Erhitzen oder Abkühlen werden Stoffe nicht chemisch verändert.
Viele Stoffe, z.B. Sand und Wasser, kann man miteinander vermischen, ohne dass sich die Teilchen verändern. Auch die Eigenschaften der Sand- und Wasserteilchen bleiben im Stoffgemisch erhalten und können zum Trennen des Stoffgemisches genutzt werden. So erhält man durch Filtrieren oder Destillieren wieder reines Wasser und Sand.
Bei einer physikalischen Mischung entstehen keine neuen Stoffe.
-
Verbrennung von Magnesium

Chemische Reaktionen
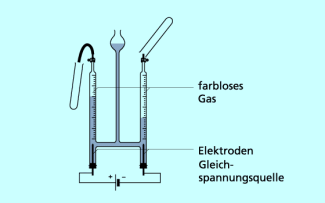
Bringt man Wasser in einen hofmannschen Apparat und schließt diesen an eine elektrische Stromquelle an, so bilden sich an den Elektroden Gasblasen.
Das eine Gas ist farblos, geruchlos und brennbar. Dieses Gas ist Wasserstoff. Das andere ist auch farblos und geruchlos, aber nicht brennbar und lässt einen glimmenden Holzspan hell aufflammen. Dieses Gas ist Sauerstoff. Durch die Einwirkung des elektrischen Stromes sind aus dem Stoff Wasser neue Stoffe mit neuen Eigenschaften entstanden. Es hat eine Stoffumwandlung stattgefunden.
Chemische Reaktion unter dem Aspekt der Stoffumwandlung
Vorgänge, bei denen neue Stoffe mit neuen Eigenschaften entstehen, nennt man chemische Reaktionen.
Zur Beschreibung chemischer Reaktionen kann man Wortgleichungen formulieren. Die Wortgleichung für die chemische Reaktion, die beim Einwirken von elektrischem Strom auf Wasser abläuft, lautet:
Die Stoffe, die vor einer chemischen Reaktion existieren, heißen Ausgangsstoffe oder Edukte. Sie stehen in der Wortgleichung vor dem Pfeil. Der Pfeil gibt die Richtung der chemischen Reaktion an. Stoffe, die nach einer chemischen Reaktion vorliegen, bezeichnet man als Reaktionsprodukte. Sie stehen hinter dem Pfeil.
Um festzustellen, ob bei einem Experiment eine chemische Reaktion stattgefunden hat, muss man die Eigenschaften der Stoffe vor und nach dem Experiment vergleichen.
Dabei muss sich nicht zwangsläufig der Aggregatzustand der Edukte und der Produkte unterscheiden, sondern ihre chemische Zusammensetzung, die durch Formeln angegeben wird.
Die Formelgleichung gibt statt der Bezeichnungen die chemischen Formeln der beteiligten Stoffe an. Aus ihr können auch die Stoffmengenverhältnisse der Ausgangsstoffe und Reaktionsprodukte abgelesen werden.
Aus der Formelgleichung wird ersichtlich, dass die Stoffumwandlung durch Umordnung von Teilchen erfolgt. Diese geht einher mit der Umordnung chemischer Bindungen.
-
Wasser wird im hofmannschen Apparat zersetzt.
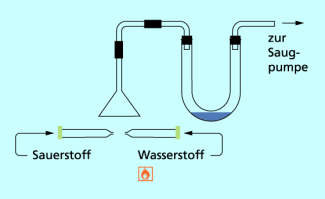
Umkehrbarkeit chemischer Reaktionen
Durch die Apparatur im Bild 3 werden mittels der Saugpumpe Sauerstoff und Wasserstoff abgesaugt.
Erwärmt man das Gasgemisch mit einer Brennerflamme, entzündet sich der Wasserstoff und brennt mit blassblauer Flamme. Im U-Rohr scheiden sich kleine Flüssigkeitstropfen ab, die sich im unteren Teil des U-Rohrs ansammeln.
Die erhaltene Flüssigkeit im U-Rohr ist farblos,und nicht brennbar. Es handelt sich um Wasser. Wiederum hat eine chemische Reaktion hat stattgefunden.
Wasser war beim ersten Experiment der Ausgangsstoff , bei der zweiten Reaktion das Reaktionsprodukt.
Es gibt demnach keinen Stoff, der prinzipiell als Ausgangsstoff oder Reaktionsprodukt festgelegt ist.
Chemische Reaktion unter dem Aspekt der Energieumwandlung
Bei der chemischen Reaktion zur Zerlegung des Wassers wurde elektrische Energie benötigt. Dagegen wurde bei der Bildung von Wasser aus den Elementen sogar Wärme frei.
Die Zerlegung des Wassers ist nur bei ständiger Energiezufuhr möglich. Elektrische Energie wird in chemische Energie der Stoffe Wasserstoff und Sauerstoff umgewandelt.
Die Bildung des Wassers aus Sauerstoff und Wasserstoff ist mit einer Umwandlung der chemischen Energie der Ausgangsstoffe in thermische Energie und Lichtenergie verbunden. Durch die Flamme des Brenners aktiviert, wird so lange Wasser gebildet, wie Wasserstoff und Sauerstoff zur Verfügung stehen..
Chemische Reaktionen sind immer mit Energieumwandlungen verbunden.
Je nachdem, ob insgesamt bei einer Reaktion thermische Energie als Wärme zugeführt werden muss oder abgegeben wird, unterscheidet man exotherme und endotherme Reaktionen .
Wird bei einer chemischen Reaktion Wärmeenergie abgegeben, so spricht man von einer exothermen chemischen Reaktion (exo = nach außen, thermos = Wärme).
Wenn bei einer chemischen Reaktion ständig Wärmeenergie zugeführt werden muss, so liegt eine endotherme chemische Reaktion (endo = nach innen) vor.
-
Entstehung von Wasser aus den Elementen