Ionenbindung
Die Ionenbindung ist eine Art der chemischen Bindung, die durch elektrostatische Anziehungskräfte zwischen elektrisch entgegengesetzt geladenen Ionen hervorgerufen wird.
Bildung von Ionen
Alle Atome streben einen energetisch günstigen Zustand an, der durch eine abgeschlossene äußere Elektronenschale gegeben ist. Im Periodensystem haben aber nur die Atome der Edelgase diese stabile Besetzung. Alle anderen Atome erreichen diesen Zustand durch chemische Reaktionen bzw. Bindungen mit anderen Partnern, wobei es verschiedene Möglichkeiten für sie gibt.
Die Elemente der ersten Hauptgruppe (Alkalimetalle) oder der zweiten Hauptgruppe (Erdalkalimetalle) haben nur ein bzw. zwei Elektronen auf der äußeren Schale. Sie können die abgeschlossene Schale leicht durch Abgabe von diesen Elektronen unter Bildung von positiv geladenen Kationen erreichen.
z. B.: Na → Na+ + e-
-
Gittermodell eines Natriumchlorid-Kristalls (Na+ = orange, Cl- = grün)
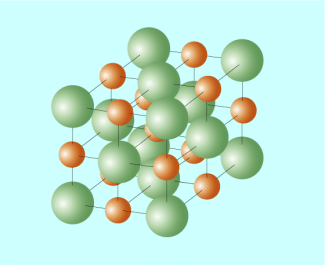
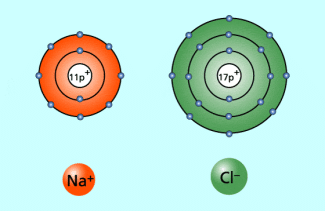
Das Natrium-Ion hat nun die abgeschlossene Schale des Edelgases Neon. Eine andere Möglichkeit für das Atom diesen Zustand zu erreichen, ist die Ausbildung einer Metallbindung im metallischen Natrium.
Den Atomen der Elemente der siebenten Hauptgruppe (Halogene) oder der sechsten Hauptgruppe fehlen nur ein bzw. zwei Elektronen zur Auffüllung der Schale. Sie können die abgeschlossene Schale leicht durch Aufnahme von Elektronen unter Bildung von negativ geladenen Anionen erreichen.
z. B.: Cl + e- → Cl-
Das Chlorid-Ion hat nun die abgeschlossene Schale des Edelgases Argon. Alternativ kann die abgeschlossene Schale über eine Atombindung durch Nutzung eines gemeinsamen Elektronpaars beispielsweise mit einem zweiten Chloratom erreicht werden.
Die Bezeichnungen Kationen und Anionen rühren daher, dass positiv geladene Ionen in einem elektrischen Feld zur negativ geladenen Kathode und negativ geladene Ionen zur positiv geladenen Anode wandern.
Entstehung der IonenbindungWenn man Natrium mit Chlor reagieren lässt, geben also die Natriumatome ihre Außenelektronen an Chloratome, welche durch Dissoziation aus Chlormolekülen entstanden sind, ab. Die entstandenen Natrium-Ionen und die Chlorid-Ionen bilden nun einen Gitterverband, der durch elektrostatische Kräfte (Ionenbindung) zusammengehalten wird. Im Gegensatz zu der auf einen Partner gerichteten Atombindung ist die Ionenbindung eine ungerichtete Bindung.
-
Natrium-Ion und Chlorid-Ion
Viele Verbindungen, die nach diesem Prinzip zwischen Elementen der ersten oder zweiten Hauptgruppe und Elementen der siebenten oder sechsten Hauptgruppe gebildet werden, weisen oft ähliche Eigenschaften auf wie Natriumchlorid (Kochsalz), d. h. hohe Schmelzpunkte, gute Löslichkeit in Wasser und Stromleitung im geschmolzenen Zustand. Daher bezeichnet man sie auch als salzartige Verbindungen.
Neben solchen einfachen Ionen, wie z. B. dem Magnesium-Ion Mg2+ und dem Sauerstoff-Ion O2- im Gitter des Magnesiumoxids, gibt es auch Molekül-Ionen, die aus mehreren Atomen bestehen, wie das Ammonium-Ion (NH4)+-Ion oder Hydronium-Ion (H3O+) als Kationen.
Beispiele für entsprechende Molekül-Anionen wären das Nitrat-Ion (NO3)- oder das Sulfat-Ion (SO4)2-.
-
Kristalle des Natriumchlorids


