organische Stoffe nur C und H Benennung
Als der Begriff von der „organischen Chemie“ um 1807 von BERZELIUS geprägt wurde stand man noch ganz am Anfang der Forschung. Zu dieser Zeit kannte man nur wenige Stoffe.
Die Benennung war in diesem Fall ganz einfach. Heutzutage sind etwa acht Millionen solcher Stoffe bekannt. Mit dieser Zunahme der Stoffe und der Internationalisierung der Forschung war es notwendig, die Benennung einheitlich vorzunehmen. Entsprechende Regeln und Erläuterungen zu ihren Anwendungen sollen in diesem Artikel beschrieben werden.
Historische Entwicklung der Nomenklatur
Die organische Chemie ist der Bereich der Chemie, der sich mit den Kohlenstoffverbindungen beschäftigt, wobei die Oxide des Kohlenstoffs, die Kohlensäure, ihre Salze und die Carbide nicht zu den organischen Verbindungen zählen.
Als der Begriff von der „organischen Chemie“ um 1807 von BERZELIUS geprägt wurde, stand man noch ganz am Anfang der Forschung. Zu dieser Zeit kannte man nur wenige organische Stoffe. Diese Stoffe waren zumeist aus Pflanzen isoliert worden. Die Benennung gestaltete sich in diesem Fall ganz einfach. So gab SCHEELE den Stoffen, die er aus Weintrauben, Äpfeln und Zitronen isolierte, ganz einfach den Namen nach den Pflanzen also Weinsäure, Äpfelsäure und Zitronensäure.
Mit zunehmender Forschung und Entwicklung der technischen Möglichkeiten wurden immer mehr organische Stoffe entdeckt. Heutzutage sind einige Millionen solcher Stoffe bekannt. Es sind beispielsweise allein 800 Inhaltsstoffe von Kaffee bekannt.
Mit dieser Zunahme der Anzahl von Stoffen und der Internationalisierung der Forschung kam ein riesiges Problem auf die Chemiker zu. Die Benennung wurde ohne festgelegte Regeln unübersichtlich. Man kann ja nicht die einzelnen Stoffe im Kaffee mit Kaffee 1 bis Kaffee 800 bezeichnen. Außerdem mussten Namen gefunden werden, die in der ganzen Welt verständlich sind.
IUPAC
Dieser Aufgabe der Benennung von organischen Stoffen nahm sich die IUPAC an. IUPAC ist eine Abkürzung und steht für International Union of Pure and Applied Chemistry. Übersetzt bedeutet es Internationale Union für Reine und Angewandte Chemie. Die IUPAC ist eine nichtstaatliche Einrichtung und unterliegt somit keiner Regierung. Sie wurde 1919 gegründet und bildet den Dachverband für die nationalen Chemikervereinigungen. Des Weiteren sind auch zahlreiche Großfirmen Mitglieder.
Ziel der IUPAC ist es also, eine international gültige und verständliche chemische Nomenklatur aufzustellen. Dabei soll vor allem darauf geachtet werden, dass aus dem Namen auch gleich die Struktur des Stoffes kenntlich wird. Außerdem ist es wichtig, dass die Benennung so gestaltet wird, dass es zu dem Namen nur eine mögliche Struktur gibt. Allerdings ist es möglich, dass von einer Struktur mehrere Namen abgeleitet werden können.
Trivialnamen – systematische Namen
Der Name der von der IUPAC aufgestellt wurde, wird auch als systematischer Name des Stoffs bezeichnet.
Diesem steht meistens noch ein sogenannter Trivialname gegenüber. Dieser Name ist der ursprüngliche Name, der früher gegeben wurde, als es noch keine einheitlichen Regeln gab. Häufig ist dieser Trivialname im Alltag noch wesentlich gebräuchlicher und bekannter als der systematische Name, insbesondere gilt das bei sehr kompliziert aufgebauten oder schon sehr lange genutzten Verbindungen.
Als Beispiel für solche Trivialnamen sollen einmal die Ameisensäure und die Essigsäure herangezogen werden. Wo die Namen herkommen, ist unschwer zu erkennen. Die Ameisensäure ist im Gift der Ameisen enthalten, das diese als Schutz gegen Feinde einsetzen. Die Essigsäure ist im Essig vorhanden und gibt dem Essig den typisch sauren Geschmack. Beide Stoffe haben auch einen systematischen Namen, die aber im Alltag kaum eine Rolle spielen. So heißt die Ameisensäure fachsystematisch korrekt Methansäure und ist die am einfachsten gebaute Carbonsäure. Der fachsystematisch korrekte Name für die Essigsäure lautet Ethansäure.
Nomenklaturregeln nach IUPAC
Von der IUPAC wurden Regeln erarbeitet, nach denen jeder selbst den fachsystematisch korrekten Namen finden kann. Diese Regeln sind in einem Regelwerk zusammen gefasst und werden als Nomenklatur bezeichnet.
Zum Verständis der Regeln muss noch einmal auf den Unterschied zwischen Summen- und Strukturformel eingegangen werden.
Die Summenformel eines Stoffes gibt an, welche Elemente und in welchem Atomzahlenverhältnis sie in diesem Stoff vorhanden sind. Die Summenformel von Stoffen wird in chemischen Laboratorien durch spezielle quantitative (die Menge betreffende) Experimente bestimmt.
Die Summenformeln von einfachen Kohlenwasserstoffen lauten ganz allgemein immer CxHy (z. B. C2H6 für Ethan).
Während in der anorganischen Chemie fast ausschließlich mit Summenformeln gearbeitet wird, sind die Summenformeln für die Organik nahezu unbrauchbar. Diese Summenformeln sagen nämlich nicht viel aus über den Stoff. Aus ihr können keine Rückschlüsse auf Eigenschaften und Reaktionsverhalten gezogen werden. Des Weiteren sind die Summenformeln sehr ungenau. Allein für die einfache Summenformel C6H14 gibt es bereits fünf verschiedene Stoffe mit ganz verschiedenen Eigenschaften, wie zum Beispiel unterschiedliche Schmelz- und Siedetemperaturen.
Um also einen Stoff ganz genau bestimmen zu können, benötigt man eine Strukturformel . Mit der Strukturformel wird versucht, die dreidimensionale Struktur des Stoffes in eine zweidimensionale zu übertragen.
Bei der ausführlichen Strukturformel werden alle Atome an dem Platz und mit den Bindungen angegeben, die sie auch in Wirklichkeit haben. Dabei müssen natürlich Vereinfachungen vorgenommen werden. So stimmen die Winkel zwischen den einzelnen Bindungen nicht und auch die Abstände nicht. Da aus diesen ohnehin nicht so ohne Weiteres auf Eigenschaften geschlossen werden kann, sind diese Vereinfachungen trotzdem sehr gut nutzbar.
Neben den ausführlichen Strukturformeln, gibt es noch die vereinfachten Strukturformeln. Bei der vereinfachten Strukturformel werden einzelne Gruppen von Atomen zusammengefasst. Diese Gruppen bestehen aus einem Kohlenstoffatom und den dazu gehörigen besonderen Atomen oder Atomgruppen. Dadurch werden nicht alle Bindungen im Molekül widergespiegelt. Daher sind diese Formeln kürzer und besser handhabbar, trotzdem kann man noch die wichtigsten Eigenschaften eines Stoffes und seinen grundlegenden Aufbau ableiten.
Auf ein paar der grundlegendsten Regeln der Nomenklatur ( Nomenklaturregeln ) soll jetzt eingegangen werden. Die Regeln sind dabei schon in der Reihenfolge aufgeschrieben, in der sie angewendet werden sollen, und nach ihrer Priorität geordnet.
Kette oder Ring
Zur Benennung eines organischen Stoffes ist es erst einmal wie oben erläutert ganz wichtig zu wissen, wie die Strukturformel des Stoffes aussieht. Aus der Strukturformel ist dann schon das erste Merkmal zur Namensgebung zu erkennen, nämlich ob der Stoff ketten- oder ringförmig aufgebaut ist. Grundsätzlich gibt es bei Stoffen mit mehr als zwei Kohlenstoffatomen beide Formen. Der kleinste Ring ist also ein Dreieck ein sogenannter Dreiring. Liegt so ein ringförmiger Kohlenwasserstoff vor, dann erhält er vor dem Namen die Vorsilbe „cyclo“ (außer bei Aromaten).
Bei kettenförmigen Kohlenstoffatomen besteht der nächste Schritt bei der Vergabe des Namens im Herausfinden der längsten Kette von Kohlenstoffatomen durch Zählen. Die längste Kette muss dabei nicht immer die Kette sein, die gerade durchgeht. Es muss also erst einmal an jeder Verzweigung gestoppt werden und dann jede Verzweigung für sich untersucht werden.
Hat man dann die längste Kette gefunden, zählt man wie viele Kohlenstoffatome zu ihr gehören. Diese Anzahl gibt dem Stoff seinen Wortstamm, in dem die Zahl als griechisches Zahlwort in den Namen mit einfließt.
Auch bei ringförmigen Verbindungen wird die Anzahl der im Ring gebundenen Kohlenstoffatome mit dem entsprechenden griechischen Zahlwort gekennzeichnet.
Anzahl der | Wortstamm | Anzahl der C-Atome | Wortstamm |
| 1 | meth- | 11 | undec- |
| 2 | eth- | 12 | dodec- |
| 3 | prop- | 13 | tridec- |
| 4 | but- | 14 | tetradec- |
| 5 | pent- | 15 | pentadec- |
| 6 | hex- | 16 | hexadec- |
| 7 | hept- | 17 | heptadec- |
| 8 | oct- | 18 | octadec- |
| 9 | non- | 19 | nonadec- |
| 10 | dec- | 20 | eicos- |
Bindungsarten
Im Anschluss an das Zählen muss geschaut werden, welche Bindungen zwischen den einzelnen Kohlenstoffatomen in der längsten Kette vorliegen. Liegen nur Einfachbindungen vor, also sind die Kohlenstoffatome miteinander nur durch ein gemeinsames Elektronenpaar gebunden, so nennt man die Stoffe auch gesättigt, da sie keine weiteren Atome oder Atomgruppen aufnehmen können.
Gibt es dagegen Mehrfachbindungen, also Kohlenstoffatome, die über mehr als ein gemeinsames Elektronenpaar miteinander verbunden sind, spricht man von ungesättigten Stoffen.
Diese besonderen Strukturmerkmale (auf die Hauptkette bezogen) werden im Namen durch entsprechende Endungen verdeutlicht:
- Einfachbindung zwischen den Kohlenstoffatomen: Endung -an
- Doppelbindung zwischen zwei Kohlenstoffatomen: Endung -en
- Dreifachbindung zwischen zwei Kohlenstoffatomen: Endung -in
Liegen mehrere Doppel- oder Dreifachbindungen vor, wird vor die jeweilige Endung das griechische Zahlwort gesetzt (z.B. Butadien weist zwei Doppelbindungen auf).
Ort der Bindung
Sollte eine Mehrfachbindung vorliegen, muss angegeben werden an welcher Stelle sich diese Bindung befindet, da sich die besondere Bindung zwischen verschiedenen Kohlenstoffatomen befinden kann. Das gilt auch, wenn mehrere Doppel- oder Dreifachbindungen vorliegen.
Die Stelle in der Kette wird durch arabische Ziffern angegeben. Um das entsprechende Kohlenstoffatom zu ermitteln, nummeriert man die Kohlenstoffatome von der Seite aus, die dem besonderen Strukturmerkmal am nächsten liegt. Die arabische Ziffer für die Stellung der besonderen Bindung steht zwischen dem Wortstamm und der Endung für die Art der Bindung bzw. gegebenenfalls vor dem griechischen Zahlwort für die Anzahl der von Einfachbindungen verschiedenen Bindungen.
Beispiel Hex-2-en: Der Name sagt aus, dass ein Kohlenwasserstoff mit sechs C-Atomen vorliegt, zwischen dem zweiten und dritten Kohlenstoffatom liegt eine Doppelbindung vor.
Beispiel Buta-1,3-dien: Der Name sagt aus, dass ein Kohlenwasserstoff mit vier Kohlenstoffatomen vorliegt. In der Kette existieren zwei Doppelbindungen. Diese befinden sich zwischen dem ersten und zweiten Kohlenstoffatom und zwischen dem dritten und vierten Kohlenstoffatom.
Liegt nur eine Doppel- oder Dreifachbindung vor und ist sie endständig, ist es nicht unbedingt notwendig, extra den Ort anzugeben. Ist dem Namen keine Ortsangabe zu entnehmen, kann davon ausgegangen werden, dass sich die Bindung zwischen dem ersten und dem zweiten C-Atom der Kette befindet.
Benennung der Seitenketten
Verzweigungen sind Atomgruppen, die ebenfalls aus Kohlenstoff- und Wasserstoffatomen bestehen, und an Stelle eines Wasserstoffatoms an einem Kohlenstoffatom der Hauptkette gebunden sind. Nachdem all die obigen Schritte abgearbeitet wurden und noch Verzweigungen vorhanden sind, müssen nun noch die Verzweigungen benannt werden. Dabei handelt es sich häufig um Alkylreste (Alkylgruppen). Eigentlich sind diese nichts anderes als Alkane, denen ein Wasserstoffatom fehlt.
Bei der Benennung gilt genau derselbe Algorithmus wie bei dem Grundgerüst des Stoffes. Es muss die Anzahl der Kohlenstoffatome in der Kette ermittelt werden, um zu wissen welches griechische Zahlwort verwendet werden muss. An dieses Zahlwort hängt man dann einfach die Endung -yl an, z. B. Methyl-; Ethyl-; Propyl-, Hexyl- usw.).
Um eine genau Struktur des Stoffes anzugeben, muss man auch sagen, wo sich die Seitenketten befinden. Dazu werden wiederum die Kohlenstoffatome der Hauptkette ermittelt, an denen sich die Seitenketten befinden und mit einer arabischen Ziffer gekennzeichnet. Die Nummerierung der Kohlenstoffatome beginnt an dem Kettenende, das der ersten Verzweigung am nächsten ist.
Beispiel 2-Methyl-propan: Der Name sagt aus, dass ein Kohlenwasserstoff mit einer Hauptkette von drei Kohlenstoffatomen vorliegt. In dieser Hauptkette liegen nur Einfachbindungen vor. Es handelt sich um einen verzweigten Kohlenwasserstoff. An dem zweiten Kohlenstoffatom der Hauptkette ist ein Wasserstoffatom durch eine Methylgruppe ersetzt.
Ein besonderes Problem ergibt sich, wenn eine Seitenkette von einem Ende der Hauptkette genau so weit entfernt ist wie eine andere Seitenkette vom anderen Ende der Hauptkette. Als Beispiel könnte hier ein Kohlenwasserstoffmolekül mit acht Kohlenstoffatomen (nur Einfachbindung in der Hauptkette) dienen mit einer Methylgruppe und einer Ethylgruppe, die sich jeweils am vierten Kohlenstoffatom vom Ende her gezählt befindet. Hier besagt die Festlegung, dass von dem Ende gezählt wird, an dem die größere Gruppe bzw. mehrere Gruppen gebunden sind. In dem obigen Beispiel würde also von dem Ende mit der Ethylgruppe aus gezählt werden (4-Ethyl-5-Methyl-Octan).
Existieren mehrere gleiche Gruppen, muss dies ebenfalls im Namen Berücksichtigung finden. Befinden sich beispielsweise zwei Methylgruppen als Seitenketten in Molekül, wird ihre Anzahl durch ein griechisches Zahlwort angegeben.
Beispiel 2,2-Dimethyl-pentan: Der Name sagt aus, dass ein Kohlenwasserstoff mit einer Hauptkette von fünf Kohlenstoffatomen vorliegt, zwischen denen nur Einfachbindungen existieren. Am zweiten Kohlenstoffatom befinden sich zwei Seitenketten. Diese bestehen jeweils aus einer Methylgruppe.
Zum Schluss der Benennung muss der Namen nur noch aufgeschrieben werden. Auch hier gibt es noch eine Regel, die aber für die Richtigkeit der Benennung unwichtig ist. Im Namen sollen die Bezeichnungen der Seitenketten in alphabetischer Reihenfolge angeordnet werden. Bei dem oben angeführten Beispiel ist das zufällig schon durch die Nummerierung passiert. Stünde aber an Stelle der Ethylgruppe eine Propylgruppe, so lautete der Namen 7-Methyl-4-Propyl-Octan.
Mithilfe einiger Beispiele kannst du überprüfen, ob du die Regeln verstanden hast und anwenden kannst. Stelle dazu die Namen für folgende Strukturen auf und überprüfe sie, indem du jeweils das Icon anklickst.
Formelbeispiel 1
![]()
Formelbeispiel 2
![]()
-
Lösung für Formelbeispiel 1
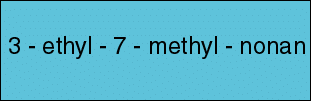
-
Lösung für Formelbeispiel 2


