pH-Wert
Der pH-Wert ist ein Maß für die Konzentration von Protonen in einer Lösung. Der Zahlenwert gibt die Konzentration als negativen dekadischen Logarithmus an. Je weniger freie Protonen in einer Lösung vorhanden sind, desto größer ist der pH-Wert. Ist die Protonenkonzentration in einer Lösung hoch, d.h. der pH-Wert niedrig, spricht man von einer sauren Lösung, ist der Protonenkonzentration niedrig, d.h. der pH-Wert hoch, spricht man von einer basischen Lösung. Als neutral wird ein pH-Wert von 7 angenommen. In Analogie zum pH-Wert wird auch ein pOH-Wert definiert, der die Konzentration an OH -Ionen angibt.
Der pH-Wert ist ein Maß dafür, wie sauer bzw. basisch eine Lösung ist. Dies hängt von der Konzentration der Protonen in der Lösung ab. Um handhabbare Zahlenwerte für die Konzentration der Protonen zu erhalten wurde der pH-Wert definiert als negativer dekadischer Logarithmus der Konzentration der Protonen.
pH = - lg c(H) bzw. pH = -lg c(HO)
In analoger Weise lässt sich auch ein pOH-Wert definieren, als negativer dekadischer Logarithmus der Konzentration von OH -Ionen.
Das Ionenprodukt des Wassers und der pH-Wert
Wasser leitet sehr geringfügig den elektrischen Strom. Die Ursache dafür liegt in der Eigendissoziation des Wassers, der Autoprotolyse.
Für diese Gleichgewichtsreaktion lässt sich das Massenwirkungsgesetz (MWG) aufstellen.
Dieses Gleichgewicht liefert nach dem MWG die temperaturabhängige Gleichgewichtskonstante K. Da die Dissoziation so gering ist, d. H. das Gleichgewicht bei der Autoprotolyse weit auf der Seite des Wassers liegt, kann die Konzentration des Wassers als konstant angesehen werden. Sie lässt sich so in die Gleichgewichtskonstante einbeziehen. Die Konstante wird als das Ionenprodukt des Wassers bezeichnet.
Bei 22°C beträgt das Ionenprodukt des Wassers 10 mol/ l.
mit der Definition des pH-Wertes und des pOH-Wertes lässt sich dafür auch schreiben:
Da in reinem Wasser nach der Reaktionsgleichung für die Autoprotolyse die Konzentration der HO-Ionen gleich der Konzentration an OH-Ionen ist, ergibt sich für den pH-Wert des reinen Wassers:
pH = 7
Dieser Wert wird auch als neutral angesehen. Bei höheren Konzentrationen von HO-Ionen ergeben sich dementsprechend niedrigere pH-Werte, bei geringeren HO Konzentrationen ergeben sich höhere pH-Werte.
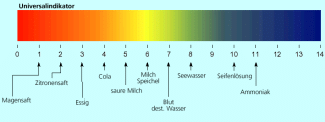
Einige Beispiele für verschiedene pH-Werte aus dem Alltag:
- Magensaft / Zitronensaft: 0,9 - 2,3
- Cola: 2,4
- Wein: 3
- saure Milch: 4,4
- Schweiß: 4 - 6,8
- Harn: 5 - 7
- Speichel: 6 - 8
- Milch: 6,4 - 6,7
- Blut: 7,4
- Seifenlösung: 8 - 10
Mit Universalindikatoren lässt sich die Konzentration der Protonen bzw. HO-Ionen durch eine definierte Farbe anzeigen. So führt bei üblichem Universalindikator eine hohe Protonenkonzentration (sauer) zu einer roten Färbung und eine niedrige Protonenkonzentration (basisch) zu einer blauen Färbung. Im neutralen Bereich ist er gelblich/grün gefärbt (vergl. Abbildung 1).
Es gibt allerdings verschiedene Inikatoren die im Sauren oder Basichen verschiedene Farbreaktionen zeigen. Ihre „Umschlagspunkte“, bei denen sie den Farbbereich wechseln, müssen nicht zwangsläufig bei einem pH-Wert von 7 liegen.
| Indikator | pH-Wert am Umschlagspunkt |
| Phenolphtalein | 8,5 - 10 |
| Brommethylblau | 6 - 7,5 |
| Methylorange | 3,2 - 4,8 |
Berechnungen von pH-Werten
pH-Wert starker Säuren und Basen
Bei starken Säure und Basen ist die Berechnung des pH-Wertes denkbar einfach. Starke Säuren und Basen liegen praktisch vollständig dissoziiert vor. Damit ist die Konzentration der HO-Ionen bzw. der OH-Ionen gleich der Konzentration der eingesetzten Säure.
Für eine wässrige Lösung einer starken Säure, z. B. Salzsäure, der Konzentration von 0,01 mol/l gilt somit:
pH-Wert schwacher Säuren und Basen
Schwache Säuren und Basen dissoziiren nicht vollständig. Man kann also nicht davon ausgehen, dass die Konzentration der Protonen bzw. HO-Ionen der Ausgangskonzentrationen der Säure entspricht, da nur ein Teil der Säuremoleküle (HA) dissoziiert vorliegen. Als Maß für die Stärke der Dissoziation (Säurestärke) wird der pKs-Wert definiert. Analog zum pH-Wert ist der pKs-Wert der negative dekadische Logarithmus der Säurekonstante . Die Konstante ist die Gleichgewichtskonstante für die Dissoziation der Säure. Aus dem MWG ergibt sich damit folgender Zusammenhang:
da ja c(A) = c(HO) ist, ergibt sich:
In dieser Gleichung ist nur noch die Konzentration der Säure im Gleichgewicht c(HA) unbekannt. Sie ergibt sich aus der Differenz von der Ausgangskonzentration Säure und dem dissoziierten Anteil c(A). Da verdünnte schwache Säuren so wenig dissoziieren, also c(A) << c(HA) ist, kann man allerdings annehmen, dass die Ausgangskonzentration der Säure nahezu gleich der Konzentration der undissoziierten Säure im Gleichgewicht ist.
-
Farbverlauf beim Universalindikator und pH-Werte einiger Lösungen