Phenol und Derivate
Phenol (Hydroxybenzen) ist der einfachste Vertreter der Stoffklasse der Phenole. Das Phenol ist giftig, kommt als reiner Stoff in der Natur selten vor, und wir deshalb größtenteils synthetisch hergestellt.
Als Phenole bezeichnet man alle vom Benzen abgeleiteten aromatischen Verbindungen, die mindestens eine OH-Gruppe direkt am aromatischen Ring enthalten. Aufgrund des Einflusses des aromatischen -Elektronensystems auf die freien Elektronenpaare des Sauerstoffs unterscheiden sich die Phenole in ihren Eigenschaften deutlich von den aliphatischen Alkoholen.
Eigenschaften und Verwendung von Phenol
Phenol findet man im Steinkohleteer , der bei der Kohleentgasung (Verkokung) anfällt, und in geringen Mengen im Kiefernholz und in den Kiefernnadeln. Der größte Teil des benötigten Phenols wird deshalb synthetisch hergestellt.
Phenol ist giftig, bildet farblose, kristalline Nadeln, die sich an der Luft rötlich färben und allmählich zerfließen. Die molare Masse beträgt 94,1 g/mol. Phenol schmilzt bei 43 °C, siedet bei 182 °C und besitzt eine Dichte von 1,132 (bei 25 °C).
Es hat einen charakteristischen durchdringenden Geruch. Es löst sich in Ether, Chloroform, etherischen Ölen und Alkohol sehr gut, in Benzen und Wasser mäßig und in aliphatischen Kohlenwasserstoffen sehr schwer.
Die Giftigkeit des Phenols beruht auf der schädigenden Wirkung auf das Protoplasma der Zellen. Wegen dieser keimtötenden Eigenschaft wurde Phenol bzw. phenolghaltige Lösungen (max. 5 % Phenol) früher in der Chirurgie als Desinfektionsmittel verwendet. Die Flüssigkeit und auch schon die Dämpfe reizen und verätzen Haut, Atemwege und Augen. Die Einnahme führt zuerst zu Atemlähmung und später zum Tod durch Herzstillstand. Bei chronischen Vergiftungen treten zuerst Nierenschäden auf. Der MAK-Wert (Maximale Arbeitsplatz-Konzentration) beträgt 5 ppm (~ 19 ). Die letale Dosis beträgt zwischen 1g (über den Mund aufgenommen) und 10 g (über die Haut aufgenommen).
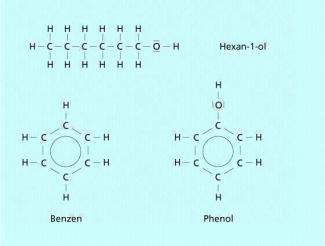
Die Summenformel von Phenol ist . Sein chemischer Name lautet Hydroxybenzen . Phenole sind formal Derivate des Benzen. Ihr Gundkörper ist der aromatische Benzenring, wobei ein oder mehrere Wasserstoffatome des Benzens durch eine Hydroxylgruppe substituiert sind. Da der Sauerstoff der phenolischen Hydroxylgruppe mit dem delokalisierten
![]()
-Elektronensystem in Wechselwirkung steht, ist das durch Deprotonierung entstehende Phenolat-Anion besonders stabilisiert (Mesomerie).
![]()
Aus diesem Grund kann das Proton der Hydroxylgruppe bei Phenolen wesentlich leichter abgespalten werden als bei aliphatischen Alkoholen. Es hat somit im Sinne von Broensted saure Eigenschaften und wird deshalb auch manchmal als Carbolsäure bezeichnet, obwohl es keine Carbonsäure ist. In Wasser dissoziiert Phenol schwach in Protonen und Phenolat-Anion. Dadurch wird auch die gute Löslichkeit von Phenol in verdünnter Lauge verständlich.
![]()
Anders als die Alkohole reagiert Phenol auch mit einer verdünnten Eisen(III)-chloridlösung in charakteristischer Art und Weise. Die Lösung färbt sich blau bis blau-violett. Diese Farbreaktion wird als Nachweis für Phenol genutzt.
Phenol kann mit vielen anderen Verbindungen zur Reaktion gebracht werden und ist deshalb ein wichtiger Ausgangsstoff in der organischen Synthesechemie. Daher sind die Verwendung smöglichkeiten des Phenols in der chemischen Industrie äußerst vielseitig.
![]()
Es bildet bei der Reaktion mit Alkalimetallen die Phenolate (Salze). Phenolate sind (im Gegensatz zu den Alkoholaten) in Wasser recht beständig. Außerdem können auch Reaktionen am aromatischen Ring stattfinden, wobei verschiedene Phenolderivate entstehen.
Ein Beispiel ist die Bildung von Salicylsäure
(2-Hydroxybenzoesäure) durch Umsetzung von Phenol mit Kohlenstoffdioxid unter starker Erwärmung. Salicylsäure ist ein Zwischenprodukt zur Herstellung des bekannten Arzneistoffs Aspirin (Acetylsalicylsäure), in der die phenolische Hydroxylgruppe noch acetyliert ist.
-
Phenol weist zwar ebenso wie Hexanol eine Hydroxy-Gruppe und sechs Kohlenstoffatome im Molekül auf, ähnelt in der Struktur aber eher dem Benzen.
Außerdem dient Phenol als Ausgangsstoff zur Herstellung von Kunststoffen, Phenolharzen, Phenolphthalein (Indikator), Pikrinsäure, Arzneimitteln, Insektiziden, Holzschutzmitteln, Sprengstoffen, Gerbstoffen u.v.m. Phenolharze werden beispielsweise durch Polykondensation aus Methanal und Phenol hergestellt. Sie waren die ersten Kunststoffe, die in der Welt hergestellt wurden. Erfinder war im Jahr 1909 LEO HENDRIK BAEKELAND in Erkner bei Berlin. Er wurde damit zum „Vater der Kunststoffe“. Die Karosserie des PKW Trabant besteht aus faserverstärktem Phenolharz.
Derivate des Phenols
Bedeutung besitzt nicht nur das Phenol selbst, sondern auch seine Derivate . Dabei handelt es sich um Verbindungen, die neben der OH-Gruppe noch weitere funktionelle Gruppen am aromatischen Ring besitzen, wie z. B. die schon erwähnte Salicylsäure.
So enthalten Phenolaldehyde mindestens eine OH- und eine CHO-Gruppe. Diese Stoffe, wie z. B. Vanillin, riechen meist recht angenehm und sind in der Natur weit verbreitet. Sie finden Verwendung als Aromen in der Parfümindustrie.
Als Phenolether werden alle die Ether bezeichnet, die mindestens einen aromatischen Rest besitzen. Auch diese Stoffe kommen teilweise natürlich vor und werden ebenfalls in der Aromen- und Parfümindustrie verwendet (Beispiele Anisol, Diphenylether).
Phenolharze sind Kunstharze, die durch die Kondensation von Aldehyden (besonders Formaldehyd) mit Phenol entstehen. Aus diesen werden vorwiegend Phenoplaste hergestellt.
Phenolphthalein ist ein organischer Farbstoff, der in sauren und neutralen Lösungen farblos ist, im alkalischen nach Rosa umschlägt. Phenolphthalein ist einer der am meisten verbreiteten Indikatoren für die Säure-Base-Titration.
Mehrwertige Phenole
Phenol e können auch mehr als eine Hydroxy-Gruppe am aromatischen Ring besitzen. Je nach Anzahl der OH-Gruppen bezeichnet man sie als einwertig, zweiwertig oder dreiwertig, da sie eben so viele Protonen abgeben können.
Einwertig: Phenol (Hydroxybenzen)
Zweiwertig:Brenzkatechin (1,2-Dihydoxybenzen), Resorcin (1,3-Dihydroxybenzen), Hydrochinon (1,4-Dihydroxybenzen),
Dreiwertig: Pyrogallol (1,2,3-Trihydroxybenzen).
Die mehrwertigen Phenole sind kristallin, in Wasser mäßig bis gut löslich und sie reagieren ebenfalls schwach sauer. Ist ein Kohlenstoffatom des Ringes noch zusätzlich mit einer oder mehreren elektronenziehenden Gruppen substituiert, z. B. mit einer Nitrogruppe , wird der Säurecharakter der phenolischen OH-Gruppe sehr stark erhöht, und kann fast die Stärke einiger Mineralsäuren (z. B. HCl, ) erreichen (z. B. Pikrinsäure = 2,4,6-Trinitrophenol).
-

Thomas Popp - Fotolia.com

