Essigsäure (Ethansäure) und Speiseessig
Die Essigsäure ist eine der wichtigsten Säuren in unserem Leben. Sie ist nicht nur ein wichtiger Bestandteil in unserem Stoffwechsel, sondern auch ein Genuss- und Würzmittel, außerdem ein Rohstoff in der Industrie. Sie entsteht auf natürlichem Wege durch Essigsäuregärung. So kann man sie gezielt gewinnen, besonders zum Einsatz als Speiseessig.
Vom Ausgangsstoff und von der Verarbeitung hängt es ab, welche Sorte entsteht.
Die seit über 7000 Jahren bekannte Säure kann auch auf verschiedenen technischen Wegen hergestellt werden.
Der Essig (latein.: acetum) ist ein saures Genuss-, Würz-, und Konservierungsmittel, das bereits den Menschen um 5 000 vor Christus bekannt war.
Die Geschichte des Essigs
Essig besteht aus Ethansäure (Essigsäure) und Wasser.
Als Speiseessig wird häufig eine 5-prozentige Lösung verwendet.
Essig war damals wie heute ein wichtiges Konservierungsmittel und Gewürz. In alten Schriften wird er als Erfrischungsgetränk für Reisen, auf der Jagd, auf Eroberungszügen und bei der Arbeit erwähnt.
HIPPOKRATES beschrieb die Anwendung des Essigs als innerliches und äußerliches Heilmittel. Über viele Jahrhunderte benutzte man die Säurelösung als Desinfektionsmittel. So wurden zum Beispiel die Pestmasken während der todbringenden Epidemien in Essig getränkt.
Ende des 14. Jahrhunderts stand die Zunft des Essigsiedens in voller Blüte. In Essigstuben, welche sich an den Südseiten der Häuser befanden, wurde das kostbare Nass hergestellt.
Die Wände dieser Stuben bestanden aus Gips, denn nur dieser Baustoff konnte den aggressiven Essigdämpfen standhalten. Als Ausgangsstoff verwendeten die Essigsieder vorzugsweise Bier, Obst- und Traubenweine, die mit Fruchtsäften, Zucker, Honig oder Malz versetzt waren.
Essig heute
Auch heute werden unterschiedliche Ausgangsmaterialien genutzt. Der Essig ist, je nach seiner Herkunft, farblos bis braun gefärbt und kommt in den Handel unter den Bezeichnungen Tafel-, Speise-, Einmachessig oder Essigessenz.
Die Essigessenz enthält dabei 15 bis 25 g Essigsäure pro 100 ml, die anderen Essigsorten nur 5 bis 15 g.
Der bei der natürlichen Gärung gewonnene Rohessig enthält noch andere organische Bestandteile, wie z. B. Aldehyde, Aceton und Essigsäureester.
Die typischsten im Handel erscheinenden Sorten sind:
- der Obstessig (z. B. Apfelessig, dem besonders gesundheitsfördernde Eigenschaften nachgesagt werden - so reguliert er den Säurehaushalt des Körpers und wirkt verdauungsfördernd und entschlackend);
- Weinessig, Spritessig und Malzessig.
- Es gibt weiterhin noch besondere Gewürz- und Kräuteressige, die z. B. Estragon enthalten können und aus Pflanzenauszügen hergestellt werden.
Essig darf nicht in Metallgefäßen gelagert werden, da die Essigsäure die meisten Metalle angreift und dabei Acetate entstehen, wie z. B. Eisen-, und Zinkacetat oder Kupferacetat.
Die Lagerung in Holzfässern ist daher nicht nur eine Alternative, sondern wird auch fast ausschließlich angewendet, da diese Lagerung die Qualität des Essigs erhöht.
Aufbau und Eigenschaften der Ethansäure
Die Essigsäure ist umgangssprachlich nach dem Würzmittel benannt. Ihr systematischer Name ist Ethansäure.
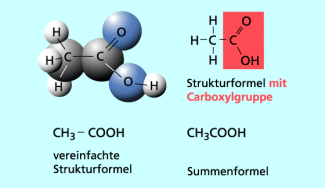
Es handelt sich um eine organische Säure (Carbonsäure), deren Moleküle zwei Kohlenstoffatome besitzen, die mit einer Einfachbindung miteinander verbunden sind (gesättigte Alkansäure).
Die funktionelle Gruppe ist, wie bei allen anderen Carbonsäuren auch, die Carboxylgruppe -COOH.
Die stark vereinfachte Strukturformel der Essigsäure ist .
physikalische Eigenschaften:
molare Masse: 60,1 g/mol
Dichte: 1,044 (bei 25°C)
Schmelztemperatur: 16,7°C
Siedetemperatur: 117,9°C
chemische Eigenschaften:
Ethansäure ist eine stechend riechende, farblose, klare, stark hygroskopische (Wasser anziehende) Flüssigkeit.
Wasserfreie Essigsäure wird Eisessig genannt. Der Name rührt daher, dass die reine Ethansäure schon bei 16,7°C zu eisähnlichen Kristallen erstarrt.
Die reine Flüssigkeit leitet den elektrischen Strom nicht und färbt Unitestindikator nicht rot.
Ethansäure ist mit Wasser, Ether, Chloroform, Ethanol, etherischen Ölen, Tetrachlormethan, Glycerol und einigen anderen Stoffen in jedem beliebigen Verhältnis mischbar.
Die Ethansäure ist eine relativ schwache bis mittelstarke Säure. Das bedeutet, dass sie mit Wasser nicht vollständig zu den Acetat-Ionen und Wasserstoff-Ionen (bzw. Oxonium-Ionen) reagiert. Trotzdem zeigt die Lösung natürlich aufgrund der enthaltenen Wasserstoff-Ionen (bzw. Oxonium-Ionen) eine saure Reaktion.
-
Modell und Formeln des Ethansäuremoleküls
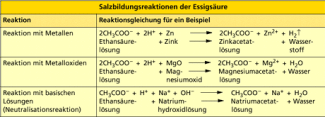
Salzbildungsreaktionen der Essigsäure
Typisch für Säuren sind Salzbildungsreaktionen. Auch die Essigsäure bildet Salze. Ihre Salze heißen Acetate.
Obwohl Essigsäure nur eine schwache Säure ist (vom Ausmaß der Protolyse her gesehen), reagiert sie mit unedlen Metallen unter Wasserstoffentwicklung. Beispielsweise bildet sich mit Kupfer das giftige Kupferacetat.
Da die Essigsäure eine stärkere Säure als Kohlensäure ist, setzt sie aus Carbonaten Kohlenstoffdioxid frei (Entfernung von Kesselstein in Haushaltsgeräten).
![]()
Eine typische Reaktion der Ethansäure ist die Esterbildung. Ethansäure kann aufgrund ihrer Carboxylgruppe mit Alkoholen reagieren.
Dabei entstehen Ethansäureester, z. B. Ethansäureethylester.
![]()
Ethansäure erkennt man noch in sehr geringen Konzentrationen an ihrem typischen Essiggeruch. Lösungen der Essigsäure, die mit Natronlauge neutralisiert werden, lassen sich mit Eisen(III)-chlorid-Lösung nachweisen.
Es bildet sich ein tiefroter Komplex, der sich beim Zusatz von Salzsäure wieder entfärbt. Diese Reaktion dient auch als spezieller Nachweis für diese Carbonsäure.
-
Salzbildungsreaktionen der Essigsäure
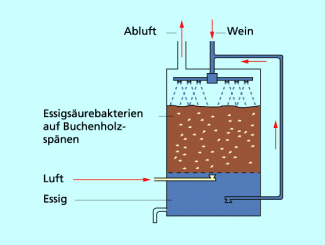
Herstellung der Ethansäure
Die älteste bekannte Methode zur Herstellung von Essigsäure ist die Essigsäuregärung durch Essigsäurebakterien, bei der unter Sauerstoffzufuhr mithilfe der Enzyme der Essigsäurebakterien ethanolhaltige Flüssigkeiten oxidiert werden.
Auch wenn dieser Stoffwechselprozess als Gärung bezeichnet wird, gehört er eigentlich nicht in diese Gruppe, denn die Essigsäuregärung findet, im Gegensatz zu den eigentlichen Gärungsvorgängen, nur mit Sauerstoff statt. Dabei wird Ethanol („Alkohol“) oxidiert.
Aber es handelt sich um einen Dissimilationsvorgang, denn organische Substanz wird zum Zweck der Energiefreisetzung umgesetzt. Die Reaktion verläuft in zwei Schritten.
Für den schrittweise ablaufenden Prozess kann folgende Gesamtgleichung angegeben werden.
Ethanol + Sauerstoff –→ Essigsäure + Wasser
Die biotechnologische Herstellung erfolgt in großen Holzbottichen. Über Buchenholzspäne wird ein Gemisch verrieselt, das Ethanol („Alkohol“) enthält.
Die Belüftung wird von unten durchgeführt, sodass für die Essigsäuregärung ausreichend Sauerstoff vorhanden ist (siehe Bild 3).
Technisch kann Ethansäure auch durch andere Verfahren gewonnen werden.
| 1. | Die Gewinnung von Essigverbindungen (z. B. Essigsäureester) durch Trockendestillation von Holz begann etwa im Jahre 1870. Der entstehende „ Holzessig “ wird gereinigt und destilliert und zu Ethansäure weiter verarbeitet. |
| 2. | Essigsäure kann man auch auf Basis von Ethen gewinnen. Durch katalytische Oxidation von Ethen erhält man Acetaldehyd, der dann weiter zu Essigsäure oxidiert wird. 2 CH2= CH2 + O2 –→ CH3– CHO 2 CH3–CHO + O2 –→ 2 CH3–COOH |
| 3. | Es ist ebenfalls möglich, die Ethansäure aus Methanol und Kohlenstoffmonooxid zu gewinnen. |
Die so hergestellte Ethansäure wird hauptsächlich zur Herstellung von verschiedenen Ethansäureestern verwendet, die wegen ihres fruchtartigen Geruches in der Parfümerie benötigt werden.
Die Salze der Ethansäure, wie z. B. Natrium-, Aluminium-, Zink- und Bleiacetat, finden in der Leder- und Textilindustrie Anwendung, sowie in der Medizin und Färberei.
Die Ethansäure dient ebenfalls als Lösungsmittel und Zwischenprodukt bei organischen Synthesen, u. a.:
| Speiseessig: | etwa 5-6 % |
| Essigessenz: | etwa 25 % |
| konzentrierte Essigsäure: | > 96 % |
| Eisessig: | 100 % |
-
Biotechnologische Herstellung von Ethansäure.