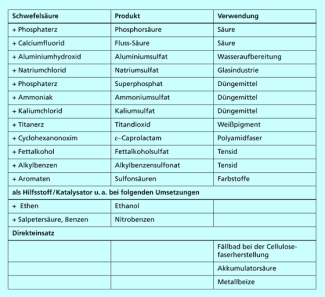
Verwendung von Schwefelsäure
Schwefelsäure ist mit einer Weltjahresproduktion von über 150 Mio. Tonnen eine der wichtigsten industriell hergestellten Chemikalien. Die Hauptmenge dient zur Produktion von Düngemitteln und zur Herstellung von Pigmenten. Außerdem ist Schwefelsäure für unzählige organisch-technische Synthesen als Reaktionspartner, Katalysator oder Reaktionshilfsmittel von großer Bedeutung. Moderne Waschmittel, Arzneistoffe, Farbstoffe für Textilien und einige Chemiefasern könnten ohne das „Blut der Chemie“ nicht oder nur mit viel größerem Aufwand hergestellt werden.
Schwefelsäure ist mit jährlich 150 Mio. Tonnen die am meisten produzierte Chemikalie der Welt. Die Verwendung der Schwefelsäure ist sehr vielseitig (Bild 2). Sie ist ein Schlüsselprodukt der chemischen Industrie, sodass in der Mitte des 20. Jh. zeitweise in Statistiken die Schwefelsäureproduktion u. a. als Kennzahl für den Industrialisierungsgrad eines Landes herangezogen wurde. Die wichtigsten Anwendungen von Schwefelsäure sind:
- Herstellung von Düngemitteln
- Aufschluss von Erzen
- Herstellung von Sulfaten (z. B. ) und anderen Säuren (z. B. HF und )
- Herstellung von Tensiden
- als Katalysator oder Reaktionshilfsmittel für organische Synthesen
- in Autobatterien (Akkumulatorsäure)
- zum Ätzen von Halbleitern
-
Ausgewählte Anwendungen von Schwefelsäure
Düngemittelproduktion
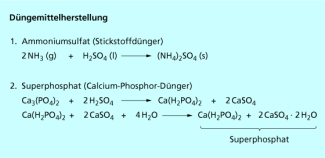
Weltweit dient die Hauptmenge (50-60 %) zur Produktion von Düngemitteln , z. B. Ammoniumsulfat oder Superphosphat, einem Gemisch aus primärem Calciumphosphat und Calciumsulfat .
Der Stickstoffdünger Ammoniumsulfat wird durch Umsetzung von Schwefelsäure mit Ammoniak hergestellt. Superphosphat wird aus natürlich vorkommenden Calciumphosphatmineralen hergestellt. Da diese wasserunlöslich sind, können die Nährstoffe von den Pflanzen nicht aufgenommen werden. Die Phosphate müssen durch Umsetzung mit Schwefelsäure aufgeschlossen und in das besser lösliche Superphosphat überführt werden (Bild 3). Superphosphat hat allerdings den Nachteil, dass es Calciumsulfat als unnötigen Ballaststoff enthält.
Herstellung von anderen Säuren
Wenn man das Tricalciumphosphat-Mineral mit größeren Mengen Schwefelsäure umsetzt, erhält man Phosphorsäure, die man vom Calciumphosphat abtrennen kann.
Ca3(PO4)2 + 3 H2SO4 → 2 H3PO4 + 3 CaSO4
Wenn man dann diese Phosphorsäure zum Aufschluss des Phosphatminerals einsetzt, erhält man das sogenannte Doppelsuperphosphat, einen hochwertigen Phosphatdünger ohne unnötiges Calciumsulfat.
-
Reaktionen zur Herstellung von Düngemitteln unter Verwendung von Schwefelsäure
Aufschluss von Erzen
Knapp 20 % der Schwefelsäure dienen der Herstellung von Titandioxid, einem der wichtigsten Weißpigmente , das in vielen Farben (weiße Wandfarbe), Kunststoffen (Fensterprofile) und Lacken enthalten ist. Titandioxid wird hauptsächlich aus Ilmenit (formal ) hergestellt, das bei 170-200 °C in konzentrierter Schwefelsäure gelöst wird. Aus der Lösung wird anschließend in mehreren Schritten Titandioxid-Hydrat gewonnen, das die weiße Farbe von vielen Gegenständen des Alltags erzeugt.
Organische Synthesen
In Deutschland dominiert mit 40-50 % der Einsatz in der organischen Chemie. Schwefelsäure dient u. a. als Ausgangsstoff zur Sulfonierung , d. h. zur Einführung von Sulfonsäuregruppen , was besonders bei der Herstellung von Tensiden (Waschmitteln), Farbstoffen und Arzneistoffen genutzt wird.
Aus dem Unterricht bekannt ist auch die katalytische und Wasser entziehende Wirkung der Schwefelsäure bei Veresterungen. In ähnlicher Weise wird sie als saurer Katalysator bei einigen organischen Synthesen eingesetzt. Obwohl der mengenmäßige Verbrauch eher gering ist, greift man doch zur Synthese vieler organischer Stoffe (Phenol, Aceton, Ester u. v. a. m.) auf den bewährten und preiswerten Säurekatalysator zurück. Insbesondere deswegen wird die Schwefelsäure auch als „Blut der Chemie“ bezeichnet.
Außerdem ist sie Bestandteil der Nitriersäure, einer Mischung von Schwefelsäure und Salpetersäure. Diese wird zur Herstellung von Nitroverbindungen wie z. B. Trinitrotoluol (TNT), Nitrocellulose und Nitroglycerin benötigt. Daraus produziert man große Mengen Sprengstoffe für militärische aber auch friedliche Zwecke. Nitroverbindungen sind aber auch wichtige Zwischenprodukte für die Herstellung von organischen Farbstoffen (Nitro- und Anilinfarbstoffe) und Arzneistoffen. So gibt man Glyceroltrinitrat Herzinfarktpatienten, weil dadurch die Gefäße erweitert und der akute Anfall beendet werden kann.
Einsatz in der nichtchemischen Industrie
Weitere 25 % der Schwefelsäure werden in der nichtchemischen Industrie eingesetzt, so handelt es sich z. B. bei der Batteriesäure in Autobatterien um Schwefelsäure. Auch die Elektronikindustrie verwendet große Mengen Schwefelsäure, hauptsächlich zum Ätzen von Halbleitern. Ohne die vielseitig verwendbare Säure würde also kein Auto gestartet werden können und viele elektronische Geräte nicht funktionieren bzw. nur zu einem deutlich höheren Preis zu haben sein.

