Seifen und Waschmittel
Seifen sind Natrium- oder Kaliumsalze von Fettsäuren. Sie sind die ältesten synthetisch hergestellten Tenside und Vorläufer unserer modernen Wasch- und Reinigungsmittel. Ihre Herstellung ist schon seit Jahrtausenden bekannt. Als grenzflächen- und waschaktive Verbindungen haben sie eine große Rolle bei der Körperpflege und der Entwicklung von Waschmitteln gespielt. Durch ihre Nachteile wurden sie allerdings weitgehend durch andere Tenside verdrängt.
Seifenherstellung
Durch Kochen von Fetten mit Holzasche wird schon seit 4 Jahrtausenden eine Klasse von grenzflächenaktiven Verbindungen gewonnen - die Seifen. Holzasche enthält unter anderem das in wässriger Lösung alkalisch reagierende Salz Pottasche Die Verseifung von Fetten wird heute mit z. B. mit Natron- oder Kalilauge durchgeführt, es bilden sich die Natrium- oder Kaliumsalze geradkettiger Monocarbonsäuren mittlerer und höherer Kettenlänge, der sogenannten Fettsäuren. In wässriger Lösung liegen die negativ geladenen Fettsäure-Anionen (Seifenanionen) frei vor, sodass Seife als anionisches Tensid bezeichnet wird.
Eigenschaften von Seifen
Für die Reinigung der menschlichen Haut ist das klassische Tensid Seife nur wenig geeignet. Seifen reagieren als Salze starker Basen mit schwachen Säuren alkalisch und sind daher hautreizend.
Die Natriumsalze der Fettsäuren, z. B. Natriumstearat - das Salz der Stearinsäure, werden aber noch als harte Kernseife zum Waschen der Hände verwendet.
Kaliumsalze von Fettsäuren sind von weicherer Konsistenz und werden Schmierseifen genannt. Sie werden heute zur Reinigung von Böden oder als Rasierseife eingesetzt.
Seifen sind als Tenside prinzipiell als Waschmittel geeignet, werden heute jedoch zu diesem Zweck kaum noch eingesetzt.
Moderne Waschmittel sind eine Weiterentwicklung der einfachen Seifen. Ihre Waschkraft beruht nicht nur auf der Tensidwirkung der enthaltenen grenzflächenaktiven Verbindungen, sondern weiteren Inhaltsstoffen wie Bleichsystemen, Enzymen, optischen Aufhellern und Weichspülern. Moderne Waschmittel sind keine reinen Reinigungsmittel mehr, sondern komplex zusammengesetzte „Gewebeconditioner“.
Historisches
Zu Beginn des 20. Jh. wurde das erste Vollwaschmittel produziert, doch schon lange davor verwendeten Menschen Seifen zum Waschen ihres Körpers und der Kleidung.
Schon auf Tontafeln der Sumerer aus dem Jahr 2500 v.Chr. findet man Hinweise und Rezepturen für die Herstellung von seifenartigen Lösungen aus Fett und Asche.
Die Ägypter kannten Stoffe, die sie zur Reinigung von Wäsche nutzten. Sie erhitzten Fette mit Soda (Natriumcarbonat) und erhielten Seife.
Die Germanen, Gallier, Griechen und Römer verwendeten die Seife vorwiegend zum Waschen von Kleidungsstücken. Im alten Rom wurde Seife aber auch vermischt mit Kräutern und Essenzen als Kosmetikum verwendet.
Im Mittelalter blühte das Handwerk der Seifensiederei.
In großen Bottichen aus Holz wurde tierisches Fett, z. B. Rindertalg, mit Pottasche oder Soda bei höheren Temperaturen mit großen Holzlöffeln verrührt.
Bereits damals wurden der entstehenden Rohseife Duftstoffe zugesetzt, die aus der Natur gewonnen wurden. Auf diese Weise erhielt man parfürmierte Seife.
Im 19. Jh. reichte die in Handwerksbetrieben produzierte Seife für den Bedarf der Menschen nicht mehr aus. Die industrielle Produktion von Seife begann. Ein Jahrhundert später wurde die Seife zum Reinigen von Wäsche durch Seifenpulver abgelöst.
Die synthetische Herstellung von Waschmitteln in großer Menge setzte ein. Die Waschwirkung und andere Eigenschaften von Waschmitteln wurden und werden ständig verbessert.
Seifen - eine Stoffgruppe
Als Verseifung wird die Spaltung von Estern mit Wasser unter dem Einfluss von basischen Substanzen bezeichnet.
Bei der Verseifung von pflanzlichen oder tierischen Fetten und Ölen erhält man den Alkohol Glycerol und die Salze der entsprechenden Fettsäuren. Da die meisten natürlich vorkommenden Fette verschiedene Fettsäuren enthalten, resultieren nach der Verseifung Mischungen verschiedener Seifen.
Bei den Seifen handelt es sich also nicht um einen definierten Stoff, sondern um eine ganze Stoffgruppe. Oft liegen Seifen als Gemische verwandter Kaliumsalze oder Natriumsalze homologer Fettsäuren mittlerer und höherer Kettenlänge vor.
Wirkung von Seifen
Die Waschwirkung von Seifen beruht auf dem Bau der Seifen-Anionen. Sie haben ein polares Ende (Carboxylat-Gruppe) mit einer negativen Ladung und ein unpolares ungeladenes Ende, das aus dem Rest der Fettsäure besteht. Diese Seifen-Anionen treten mit dem Wasser in Wechselwirkung (Bild 2).
Wasser ist ein Dipolmolekül. Die Anziehungskräfte zwischen den Wassermolekülen führen zu Wasserstoffbrückenbindungen und bedingen den Zusammenhalt der Flüssigkeit. Darum nimmt Wasser stets eine möglichst kleine Oberfläche ein. Es besitzt eine Oberflächenspannung.
Die Oberflächenspannung behindert die Waschwirkung reinen Wassers, da sich die Schmutzteilchen nicht lösen können. Durch die Teilchen der Seifenlösung wird nun diese Oberflächenspannung herabgesetzt.
-
Formelbeispiel für eine Seife
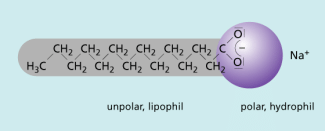
Die Seifen-Anionen lagern sich an der Wasseroberfläche an und durchstoßen mit ihrem „wasserfeindlichen“ Ende die Grenzfläche. Dadurch werden die Kräfte zwischen den Wassermolekülen herabgesetzt und die Oberflächenspannung nimmt ab.
Diese Eigenschaft der Seifen-Anionen heißt Grenzflächenaktivität. Durch diese Grenzflächenaktivität werden Stoffe und Gewebe überhaupt erst benetzbar, was eine wesentliche Voraussetzung für die Reinigung darstellt.
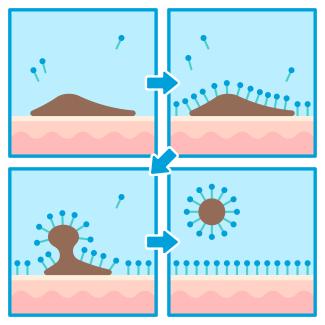
Die wasserabstoßenden Enden der Seifen-Anionen dringen in die Schmutzteilchen ein. An der Oberfläche der Schmutzteilchen entstehen Ladungen, die sich abstoßen. Die Schmutzteilchen werden so in der Schwebe gehalten und während des Spülvorgangs entfernt. Diese Eigenschaft bezeichnet man als Waschaktivität (Bild 3).
Vorteile der Seifen
Seifen sind billig und biologisch abbaubar. Das ist ein großer Vorteil. Deshalb werden häufig Schmierseifen für die Fußbodenreinigung eingesetzt. Sie haben aber oft einen unangenehmen Geruch und weisen eine schlechte Wasserlöslichkeit auf.
Im Vergleich benötigt man viel mehr Schmierseife, als würde man ein modernes synthetisches Reinigungsmitteln verwenden. Dies führt zu einer hohen Umweltbelastung.
Sehr oft wird Neutralseife mit Schmierseife verwechselt. Schmierseife oder Seife ist immer alkalisch, deshalb ist Neutralseife keine echte Seife, sondern sie besteht aus verschiedenen synthetischen Tensiden.
Moderne Seifenreiniger sind industriell hergestellte Gemische aus Neutralseife und Schmierseife.
Sie sind für die Wischpflege von Linoleumböden, aber auch PVC und vieler Steinböden geeignet. Sie wirken reinigend, und da nach dem Wischen ein hauchdünner, aufpolierbarer seidenmatter Film aus Kalkseifen (aus den Calcium-Ionen des Putzwassers und den Seifen) auf dem Boden zurückbleibt, wirken sie auch pflegend. Dieser Film ist rutschhemmend und antistatisch. Deshalb ist er auch in PC-Räumen ideal. Während viele Fußbodenpflegemittel auf Wachsbasis (Wischwachse, Selbstglanzemulsionen) sonst dicke Schichten aufbauen, die ab und zu gründlich entfernt werden müssen, ist dies bei den Seifenreinigern nicht der Fall.
Nachteile der Seifen
Seifen weisen zwar die für eine Waschwirkung erwünschte Grenzflächen- und Waschaktivität auf, haben aber auch wichtige Nachteile.
In Gebieten mit sehr hartem Wasser benötigt man sehr viel Seife, um eine Waschwirkung zu erzielen. Ursache dafür sind die vielen Calcium-Ionen im harten Wasser. Seifen-Anionen reagieren mit diesen Calcium-Ionen. Dabei bilden sich schwer lösliche Kalkseifen, die ausfallen und damit die Wirkung der Seifen-Anionen verhindern. Erst wenn praktisch alle Calcium-Ionen ausgefällt sind, können die Seifenmoleküle in Lösung gehen und ihre Waschwirkung entfalten. Man beobachtet beim Waschen mit hartem Wasser nach Ausfällung der Kalkseifen erst zu diesem Zeitpunkt eine Schaumbildung, weil für die Schaumbildung die gelösten Seifen erforderlich sind. Der naheliegende Schluss, dass für eine Waschwirkung Schaum vorteilhaft ist, ist aber falsch. Für die Entfernung von Schmutz spielt der Schaum keine Rolle, er stört eher als dass er zu etwas nütze ist.
Ablagerungen unlöslicher Kalkseifen machen Gewebe fleckig und unansehnlich und außerdem brüchig. Ablagerungen von Kalkseifen an Waschbecken oder Badewannen müssen mühsam entfernt werden. Aber auch in Kombination mit verdünnten Säuren kommt es zu Fleckenbildung: Es scheiden sich schmierige freie Fettsäuren ab.
Seifenlösungen reagieren alkalisch, unsere Haut, viele Oberflächen (Aluminium, Gummi, Linoleum...) reagieren darauf empfindlich, Naturfasern wie Wolle und Seide werden geschädigt.
Seifenlösungen reagieren basisch und können Fasern aus peptidisch verknüpften Aminosäuren hydrolysieren.
In modernen Waschmitteln sind Seifen heute nicht mehr enthalten, ihre Funktion wird durch andere Tenside übernommen.
-
Waschaktivität von Seife (Tensiden)
Suzuki Leona - shutterstock
Spezialseifen
Gallseife
Gallseife besteht aus Seife und bis zu 8% Rindergalle. Durch die Gallentenside (Cholesterolderivate) wird die emulgierende Wirkung der Seifen verstärkt, weshalb Gallseife besonders für die Entfernung fetthaltiger Flecken geeignet ist.
Gallseifen sind gute Fleckentfernungsmittel für Textilien aus pflanzlichen oder synthetischen Fasern.
Seifenspiritus
Die Seifen lieferten früher ein sehr verbreitetes Fleckenentfernungsmittel, den Seifenspiritus. Dies ist ein 1 : 1 Gemisch aus Schmierseife und Spiritus. Der Seifenspiritus kann heute noch in der Apotheke gekauft werden und ist ein guter Tipp für hartnäckige Flecken (Farbwachs, Lippenstift, Filzstift, Kugelschreiber, gealterte Grasflecken...).

