Das Tröpfchenmodell
Die Atommodelle von E. RUTHERFORD (1911) und N. BOHR (1913) waren Modelle für die Atomhülle. Vom Atomkern war in dieser Zeit lediglich bekannt, dass in ihm weitgehend die Masse des Atoms konzentriert ist und er eine positive Ladung trägt. Genauere Vorstellungen über seine Struktur entwickelten sich erst ab den dreißiger Jahren des 20. Jahrhundert im Zusammenhang mit dem experimentellen Nachweis des Neutrons durch J. CHADWICK (1932) und den weiteren Untersuchungen zu Kernumwandlungen, die u. a. von E. FERMI, F. JOLIOT-CURIE und O. HAHN durchgeführt wurden. Als besonders tragfähig erwiesen sich das Tröpfchenmodell und das Potenzialtopfmodell.
Von der Atomhülle zum Atomkern
Das 1911 von dem britischen Physiker ERNEST RUTHERFORD (1871-1937) vorgestellte und 1913 von dem dänischen Physiker NIELS BOHR (1885-1962) weiterentwickelte Atommodell war im Wesentlichen ein Modell für die Atomhülle, mit dem z.B. die Emission und Absorption von Licht erklärt werden konnten. Vom Atomkern war in dieser Zeit lediglich bekannt, dass in ihm weitgehend die Masse des Atoms konzentriert ist und er eine positive Ladung trägt. Genauere Vorstellungen über seine Struktur entwickelten sich erst ab den dreißiger Jahren des 20. Jahrhundert. 1932 wies J. CHADWICK (1891-1974) experimentell die von RUTHERFORD bereits 1921 vermutete Existenz eines elektrisch neutralen Kernteilchens, des Neutrons, nach. 1934 entdeckten FREDERICK JOLIOT-CURIE (1900-1958) und seine Frau IRENE (1897-1956) die künstliche Radioaktivität. ENRICO FERMI (1901-1954) beschoss verschiedene Elemente mit Neutronen und erzeugte damit erstmals ein Transuran. 1938/39 entdeckten OTTO HAHN, FRITZ STRASSMANN und LEISE MEITNER die Kernspaltung. Damit wurde auch die Frage immer drängender, wie der Atomkern strukturiert ist und mit welchen Modellen man die oben genannten Vorgänge beschreiben kann.
Ein wichtiger Schritt war die Entwicklung des Tröpfchenmodells, das geeignet ist, Prozesse der Kernumwandlung zu verstehen.
Das Tröpfchenmodell
Aus theoretischen Überlegungen und experimentellen Untersuchungen war bekannt: Der Kernradius ist im Vergleich zum Atomradius außerordentlich klein. Der Atomkern ist positiv geladen. Seine Bestandteile, die Nukleonen, sind positiv geladene Protonen und elektrisch neutrale Neutronen, wobei die Masse beider Teilchen näherungsweise gleich groß ist. Kernmaterie hat eine sehr große und für alle Elemente etwa gleiche Dichte, da die Protonen und die Neutronen dicht gepackt sind. Darüber hinaus war bekannt, dass sich z.B. durch Beschuss mit Neutronen Kernumwandlungen vollziehen können und Kernmaterie sich wie ein inkompressibler Stoff verhält. In Analogie zu Wassertropfen, die man sich aus kleinsten Tröpfen zusammengesetzt denken kann und die auch inkompressibel sind, kann man den Atomkern als ein Gebilde beschreiben, das aus winzigen Teilchen zusammengesetzt ist, die dicht gepackt sind und sich ähnlich wie ein Wassertropfen verhalten. Daher rührt die Bezeichnung Tröpfchenmodell. Nach diesem Modell besteht der Atomkern aus dicht gepackten Protonen und Neutronen.
Mithilfe dieses Modells lassen sich einige Eigenschaften des Atomkerns gut beschreiben:
| Aufgrund der Packungsdichte der Nukleonen (Protonen, Neutronen) wächst der Kernradius mit der Nukleonenzahl (Massenzahl) A, für die gilt: A = N + Z Dabei ist N die Anzahl der Neutronen im Atomkern (Neutronenzahl) und Z die Anzahl der Protonen (Protonenzahl). Diese Zahl ist somit gleich der Kernladungszahl und darüber hinaus gleich der Ordnungszahl im Periodensystem der Elemente. Für den Kernradius gilt näherungsweise die Beziehung: Im Bereich mittlerer Ordnungszahlen liegen die Massenzahlen bei etwa A = 100. Damit erhält man einen Kernradius von | |
| Die Dichte der Kernmaterie kann aus Masse und Volumen berechnet werden. So erhält man für einen beliebigen Atomkern mit der Massenzahl A: |
Die Protonen im Atomkern stoßen sich aufgrund ihrer Ladung gegenseitig ab. Trotzdem ist der Atomkern in der Regel stabil. Ursache dafür ist eine Kraft zwischen den Nukleonen, die als Kernkraft bezeichnet wird und die folgende Besonderheiten aufweist: Die anziehende Kernkraft wirkt zwischen jeweils zwei Nukleonen, hat eine sehr geringe Reichweite von etwa und ist erheblich stärker als die coulombsche Kraft, die aufgrund der positiven Ladung zwischen den Protonen (coulombsche Kraft) wirkt.
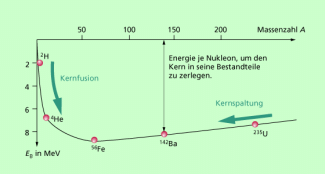
Die Bindungsenergie des Atomkerns ist ähnlich wie bei einem Wassertropfen von der Anzahl der Protonen und Neutronen abhängig (Bild 2). Bei niedriger Kernladungszahl (wenigen Protonen) ist die Bindungsenergie je Nukleon relativ gering. Bei hoher Kernladungszahl (vielen Protonen) ist dieser Wert wegen der elektrostatischen Abstoßung der Protonen dieser Wert ebenfalls relativ gering. Zwischen diesen beiden Extremen existieren Kernladungszahlen, bei denen ein Maximalwert der Kernbindungsenergie je Nukleon erreicht wird. Das ist im Bereich der Elemente Eisen, Nickel und Cobalt der Fall (siehe Bild 2).
Die Masse eines Atomkerns ist wegen der Bindungsenergie stets kleiner als die Summe der Massen seiner Bestandteile. Diese Massendifferenz wird als Massendefekt bezeichnet und kann folgendermaßen berechnet werden:
Nach der einsteinschen Beziehung zwischen Masse und Energie entspricht diesem Massendefekt eine Energie von:
Diese Energie ist gleich der Bindungsenergie des Atomkerns.
Beachte: Das Vorzeichen des Massendefektes hängt davon ab, wie man ihn definiert. Er kann im Unterschied zur genannten Definition auch so definiert werden wie im Berechnungsbeispiel. Der Wert unterscheidet sich nur im Vorzeichen.
| Aus dem in Bild 2 dargestellten Diagramm ergeben sich zwei bedeutsame Folgerungen: | |
| Durch Zusammenfügen von leichten Atomkernen oder Kernteilchen wird Energie freigesetzt. Dieser Prozess, der im Inneren von Sternen oder bei der Explosion einer Wasserstoffbombe vor sich geht, wird als Kernfusion bezeichnet. | |
| Durch Aufspalten schwerer Atomkerne oder durch Abtrennen von Kernteilchen wird ebenfalls Energie freigesetzt. Das geschieht bei natürlichen radioaktiven Zerfällen und bei der Kernspaltung. | |
Suche nach passenden Schlagwörtern
- Berechnung
- Tröpfchenmodell
- Bindungsenergie des Atomkerns
- Neutronen
- Massenzahl
- Atomhülle
- Neutronenzahl
- Kernladungszahl
- Atommodell
- Massendefekt
- Potenzialtopfmodell
- Kernmaterie
- Modelle des Atomkerns
- Nukleonen
- Protonen
- Atomkern
- Kraftkraft
- Kernbindungsenergie je Nukleon
- Protonenzahl
- Kernfusion
- Simulation
- Kernradius
- Rechenbeispiel
- Kernspaltung
- Atomradius