Reale Gase und das Modell ideales Gas
Gase bestehen wie alle Stoffe aus Atomen und Molekülen. Diese Elementarteilchen nehmen einen bestimmten Raum ein. Zwischen ihnen wirken Kräfte. Die tatsächlich in Natur und Technik existierenden Gase werden in der Physik als reale Gase bezeichnet.
Um die Zusammenhänge zwischen Temperatur, Druck und Volumen von Gasen in einfacher Weise mathematisch beschreiben zu können, wird in der Physik das Modell ideales Gas genutzt. Es ist wie jedes Modell eine Vereinfachung der Wirklichkeit. Trotzdem können viele reale Gase in guter Näherung mit dem Modell ideales Gas beschrieben werden.
Reale Gase
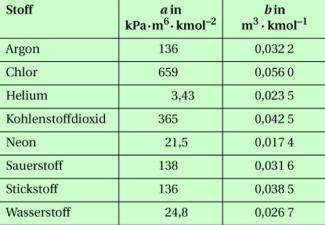
Auf solche Gase ist ein einfaches Teilchenmodell anwendbar (Bild 1), wie man es z.B. auch zur Deutung der verschiedenen Aggregatzustände anwendet und das folgendermaßen charakterisiert werden kann:
- Alle Stoffe (Gase) bestehen aus Teilchen.
- Zwischen den Teilchen wirken anziehende bzw. abstoßende Kräfte.
- Die Teilchen befinden sich in ständiger Bewegung.
Die tatsächlich in Natur und Technik existierenden Gase, z.B. Wasserstoff, Stickstoff oder Kohlenstoffdioxid, werden in der Physik als reale Gase bezeichnet. Eine exakte Beschreibung solcher Gase ist recht kompliziert, weil man z.B. bei der Betrachtung des Volumens das Eigenvolumen der Gasmoleküle berücksichtigen müsste, das bei den verschiedenen Gasen auch noch unterschiedlich ist. Wie in vielen Bereichen der Physik hat man sich deshalb ein Modell geschaffen, das es ermöglicht, Zusammenhänge einfacher und trotzdem eindeutig zu beschreiben.
Das Modell ideales Gas
Wie jedes Modell ist auch das Modell ideales Gas eine Vereinfachung der Wirklichkeit. Es lässt sich folgendermaßen charakterisieren:
- Die Teilchen des Gases werden als Massepunkte betrachtet, denen zwar eine Masse, aber kein Volumen zugeordnet wird. Es wird also das Modell Massepunkt genutzt.
- Zwischen den Teilchen treten keine anziehenden und abstoßenden Kräfte auf.
- Die Stöße zwischen den Teilchen untereinander sowie zwischen den Teilchen und den Wänden des Gefäßes erfolgen vollkommen elastisch.
Veranschaulich kann man sich das Modell ideales Gas durch sehr kleine, hochelastische Kugeln, die sich in einem abgeschlossenen Raum befinden. Solche realen Gase wie Wasserstoff und Helium verhalten sich annähernd wie das ideale Gas. Das gilt auch für andere Gase (Luft, Sauerstoff, Stickstoff usw.) bei höherer Temperatur und geringem Druck. Damit gilt auch:
Gesetze, die für das ideale Gas formuliert werden, gelten näherungsweise auch für reale Gase. Ob diese Näherung hinreichend genau ist, hängt von den gegeben Bedingungen ab und muss im Einzelfall abgeschätzt werden.
Hinweis: In der Literatur wird mitunter von realen und idealen Gasen geschrieben. Das ist insofern ungünstig formuliert, weil es nur das eindeutig festgelegte Modell ideales Gas gibt. Die idealen Gase existieren nicht, wohl aber reale Gase, die sich annähernd wie das ideale Gas verhalten und mit diesem Modell hinreichend genau beschrieben werden können.
Zustandsgleichungen für reale Gase und das ideale Gas
Der Unterschied zwischen den tatsächlich existierenden realen Gasen und dem Modell ideales Gas wird deutlich, wenn man sich die Struktur der Zustandsgleichungen ansieht.
Die Zustandsgleichung für das ideale Gas, auch Grundgleichung der kinetischen Gastheorie genannt, lautet:
-
Reale Gase und das Model ideales Gas
Für reale Gase hat der niederländische Physiker JOHANNES DIDERIK VAN DER WAALS (1837-1923) eine analoge Gleichung aufgestellt, die als van der waalssche Zustandsgleichung bezeichnet wird und die folgende Struktur hat:
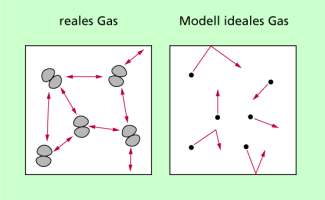
Die Größen a und b sind stoffspezifische Konstanten, die als van der waalssche Kostanten bezeichnet werden und deren Werte man in Tabellenwerken nachschlagen kann. Einige Werte sind in Bild 2 angegeben.
Vergleicht man beide Zustandsgleichungen, dann wird deutlich:
- Durch den Term wird das Eigenvolumen der Moleküle erfasst, das beim idealen Gas vernachlässigt wird.
- Durch den Term wird der sogenannte Binnendruck in einem realen Gas erfasst, der zum Außendruck hinzukommt und der durch die anziehenden Kräfte zwischen das Gasmolekülen zustandekommt. Auch er wird beim idealen Gas vernachlässigt.
-
Van der waalssche Konstanten für einige ausgewählte Gase