Sieden und Kondensieren
Als Sieden bezeichnet man den Übergang vom flüssigen in den gasförmigen Aggregatzustand, als Kondensieren den umgekehrten Übergang vom gasförmigen in den flüssigen Aggregatzustand.
Dabei gilt:
- Siedetemperatur und Kondensationstemperatur sind gleich groß. Sie hängen vom jeweiligen Stoff und vom Druck ab.
- Verdampfungswärme und Kondensationswärme sind für einen bestimmten Stoff ebenfalls gleich groß.
Bei Sieden und Kondensieren gilt:
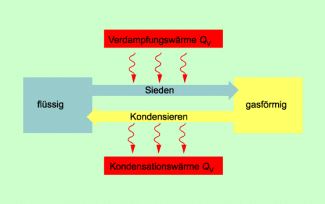
- Wird einer Flüssigkeit Wärme zugeführt, dann geht sie bei der Siedetemperatur in den gasförmigen Aggregatzustand über. Die zum Sieden erforderliche Wärme wird als Verdampfungswärme bezeichnet.
- Wird einem Gas Wärme entzogen, dann geht sie bei der Kondensationstemperatur in den flüssigen Aggregatzustand über. Die beim Kondensieren frei werdende Wärme wird als Kondensationswärme bezeichnet.
- Während des Siedens und des Kondensierens bleibt die Temperatur eines Körpers gleich groß.
- Beim Sieden vergrößert sich das Volumen eines Körpers, beim Kondensieren verringert es sich.
Die Zusammenhänge beim Sieden und Kondensieren sind in Bild 2 dargestellt.
Siede- und Kondensationstemperaturen
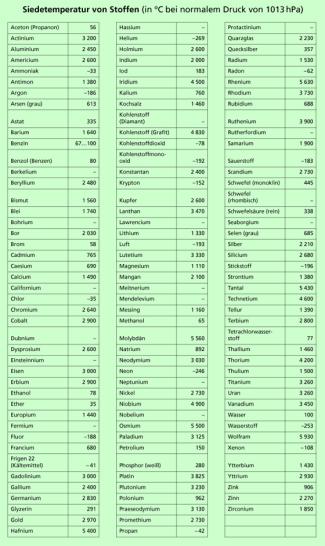
Die Siede- bzw. Kondensationstemperaturen können sehr unterschiedlich sein. Meist werden diese Temperaturen auf den normalen Luftdruck von 1.013 hPa bezogen.
Dabei ist zu beachten: Es gibt auch Stoffe, für die man keine genaue Siedetemperatur, sondern nur einen Temperaturbereich angeben kann, in dem sie sieden. Es sind sogenannte amorphe Stoffe. Zu ihnen gehören z. B. Wachs und Glas.
Bei vielen Stoffen spielt die Druckabhängigkeit der Siedetemperatur eine Rolle. Für Wasser und die meisten anderen Stoffe gilt:
Je größer der Druck ist, desto höher ist die Siedetemperatur.
Wird z. B. in einem Topf der Druck erhöht, so siedet das Wasser nicht bei einer Temperatur von 100 °C wie beim normalen Luftdruck von 101,3 kPa, sondern bei höheren Temperaturen. Das wird bei Schnellkochtöpfen und in Kraftwerken (Dampfkreislauf) genutzt. Umgekehrt ist auf hohen Bergen der Luftdruck niedriger und demzufolge ist auch die Siedetemperatur von Wasser geringer als 100 °C. Die folgende Übersicht zeigt, wie sich die Siedetemperatur von Wasser mit dem Druck verändert.
Druck in kPa | Siedetemperatur in °C |
| 1 5 10 50 100 500 1 000 5 000 10 000 20 000 | 7 33 46 81 100 152 180 264 311 366 |
Spezifische Verdampfungswärme und Verdampfungswärme
Zum Sieden eines Stoffes ist Wärme erforderlich, die beim Kondensieren wieder frei wird. Die für einen Stoff zum Sieden erforderliche Wärme wird durch die spezifische Verdampfungswärme charakterisiert.
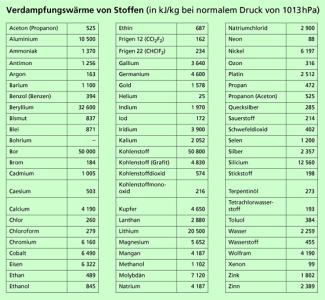
Die spezifische Verdampfungswärme gibt an, wie viel Wärme erforderlich ist, um 1 kg eines Stoffes zu verdampfen.
| Formelzeichen: |
| Einheit: | ein Kilojoule je Kilogramm |
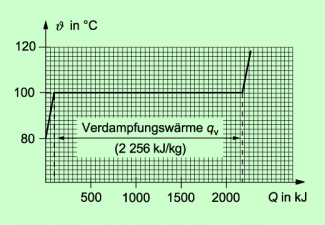
Für 1 kg Wasser beträgt diese spezifische Verdampfungswärme
2.256 kJ/kg. Der Temperaturverlauf beim Sieden von Wasser ist in Bild 4 dargestellt.
Besitzt ein Körper eine beliebige Masse m, dann kann die zum Verdampfen des Körpers erforderliche Verdampfungswärme mit folgender Gleichung berechnet werden:
Die spezifischen Verdampfungswärmen verschiedener Stoffe sind in Bild 5 angegeben.
Deutung des Siedens und Kondensierens mit dem Teilchenmodell
Mit dem Teilchenmodell lassen sich die Vorgänge beim Sieden folgendermaßen deuten: Bei Zufuhr von Wärme erhöht sich die kinetische Energie der Teilchen der Flüssigkeit. Die Teilchen bewegen sich heftiger, ihr mittlerer Abstand voneinander vergrößert sich. Schließlich können sie die Flüssigkeit verlassen und sich beliebig gegeneinander bewegen. Der Stoff liegt dann als Gas vor.
Beim Kondensieren vollziehen sich die Vorgänge in umgekehrten Richtung: Bei Wärmeabgabe verringert sich die kinetische Energie der Teilchen. Auch ihr mittlerer Abstand voneinander verringert sich. Schließlich werden sie aneinandergebunden und liegen dann wieder als Flüssigkeit vor.
Begriff Phasenübergang 1. Art
Der Übergang von einem Aggregsatzustand in einen anderen, der bei einer bestimmten Temperatur vor sich geht, wird auch als Phasenübergang oder genauer, als Phasenübergang 1. Art bezeichnet. Man spricht dann von der flüssigen Phase und von der gasförnmigen Phase. Der Phasenübergang erfolgt diskontinuierlich, d.h. bei genau einer bestimmten Temperatur. Das ist bei allen kristallinen Stoffen der Fall. Darüber hinaus gibt es bei amorphen Stoffen auch einen Übergang zwischen zwei Phasen, der sich in einem Temperaturintervall vollzieht. Einen solchen Phasenübergang, für den man keine eindeutige Siedetemperatur oder Kondensationstemperatur angeben kann, wird als Phasenübergang 2. Art bezeichnet.
Phasenübergang und Entropie
Betrachtet man einen Körper aus thermodynamischer Sicht, so ändert sich bei Änderung des Aggregatzustandes oder der Phase auch die Entropie des Systems. Für das Sieden und Kondensieren gilt: Beim Sieden erhöht sich die Entropie eines Körpers, beim Erstarren verringert sie sich. Das korreliert mit der Deutung im Teilchenmodell und der Deutung der Entropie als Grad der Unordnung: Beim Sieden vergrößert sich die Unordnung der Atome bzw. Moleküle, beim Kondensieren wird der Grad der Ordnung größer.
Eine besondere Erscheinung - der Siedeverzug
Erhitzt man reines Wasser in einem reinen Gefäß bei Vermeidung jeder Erschütterung, so kann man es mehrere Grad über den normalen Siedepunkt von 100 °C erhitzen, ohne dass es zu sieden beginnt. Diese Erscheinung wird als Siedeverzug bezeichnet. Durch eine kurze Erschütterung setzt das Sieden schlagartig, teilweise explosionsartig, ein. Um diese Erscheinung zu vermeiden, wird häufig mit Siedesteinen gearbeitet, die in das Wasser gegeben werden und den Siederverzug verhindert. Siedeverzug tritt ohne diese Maßnahme mitunter auch bei Glasgefäßen auf, in denen Wasser längere Zeit siedet. Sie äußert sich dann in schlagartigen Geräuschen.
Suche nach passenden Schlagwörtern
- gasförmige Phase
- Siedetemperatur
- Berechnung
- Phasenübergang 2. Art
- spezifische Verdampfungswärme
- Kondensieren
- kristalline Stoffe
- Aggregatzustand
- Phasenübergang 1. Art
- Kondensationswärme
- Druckabhängigkeit der Siedetemperatur
- Temperatur
- Schnellkochtöpfe
- amorphe Stoffe
- Verdampfungswärme
- Phase
- Kraftwerke
- Rechenbeispiel
- Volumen
- flüssige Phase
- Sieden