Teilchenmodelle
Alle Stoffe sind aus sehr kleinen Teilchen, den Atomen und Molekülen, aufgebaut. Den Aufbau von Stoffen kann man mithilfe von Teilchenmodellen beschreiben bzw. veranschaulichen. Die Modelle ermöglichen es auch, eine Reihe von Erscheinungen zu deuten bzw. zu erklären.
Je nach ihrem Verwendungszweck gibt es sehr unterschiedliche Arten von Teilchenmodellen: Neben ideellen Modellen in Form eines Aussagensystems nutzt man auch verschiedene materielle (gegenständliche) Modellen, z.B. um die Struktur von Stoffen anschaulich zu machen.
Teilchenmodelle
Alle Stoffe sind aus sehr kleinen Teilchen, den Atomen und Molekülen, aufgebaut. Den Aufbau von Stoffen kann man mithilfe von Teilchenmodellen beschreiben bzw. veranschaulichen. Bild 1 zeigt dafür ein Beispiel. Die Modelle ermöglichen es auch, eine Reihe von Erscheinungen zu deuten bzw. zu erklären.
Ein einfaches Teilchenmodell
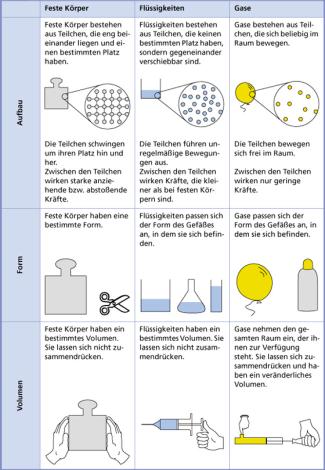
In Bild 2 ist ein einfaches Teilchenmodell dargestellt, das häufig in Form eines Aussagensystems angegeben wird. In dieser Form ist es ein ideelles Modell. Seine Grundaussagen lauten:
- Alle Stoffe bestehen aus Teilchen.
- Die Teilchen befinden sich in ständiger Bewegung.
- Zwischen den Teilchen wirken anziehende bzw. abstoßende Kräfte.
Für diese Aussagen gibt es eine Reihe von experimentellen Belegen und auch von Belegen aus dem Erfahrungsbereich:
- Löst man z. B. Zucker in Tee, so kann man nach kurzer Zeit den Zucker nicht mehr sehen, ihn aber schmecken. Offensichtlich hat sich der Zucker im Tee in sehr kleinen, mit bloßem Auge nicht sichtbaren Teilchen verteilt.
- Luft mit den Hauptbestandteilen Stickstoff und Sauerstoff ist überall um uns vorhanden. Bei Wind spüren wir sie auch. Die Bestandteile der Luft sind für uns nicht sichtbar, aber vorhanden. Auch Gase bestehen aus sehr kleinen Teilchen.
- Gibt man einige Tropfen Tinte in ein Glas mit warmem Wasser, so verteilt sich die Tinte von selbst relativ schnell im gesamten Wasser. Den Rauch von Zigaretten kann man in einem Raum an verschiedenen Stellen wahrnehmen. Dieses Durchmischen von Stoffen kommt zustande, weil sich die Teilchen aller Stoffe bewegen. Ein Beleg dafür ist auch die brownsche Bewegung und die Diffusion von Stoffen.
- Eine Stahlfeder kann man auseinanderziehen. Lässt man ein Ende los, so nimmt sie wieder ihre ursprüngliche Form an. Die Luft in einer Luftpumpe lässt sich zusammendrücken, aber nicht beliebig weit. Zwischen den Teilchen von Körpern wirken offensichtlich anziehende bzw. abstoßende Kräfte. Die anziehenden Kräfte werden als Kohäsionskräfte bzw. als Adhäsionskräfte bezeichnet.
-
Mit einem einfachen Teilchenmodell kann man eine Reihe von Erscheinungen deuten bzw. erklären.
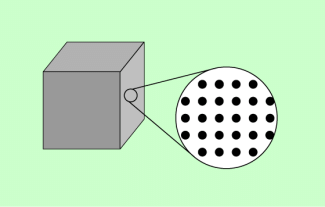
Das beschriebene einfache Teilchenmodell ist gut geeignet, die Unterschiede zwischen Stoffen in verschiedenen Aggregatzuständen zu verdeutlichen. Feste Körper, Flüssigkeiten und Gase bestehen zwar alle aus Teilchen, unterscheiden sich jedoch in ihrem Aufbau, ihrer Form und ihrem Volumen. Die Unterschiede sind in der Übersicht in Bild 2 zusammengestellt.
Das Teilchenmodell ist auch gut geeignet, solche Erscheinungen wie das Schmelzen und Erstarren, das Sieden und Kondensieren, das Verdampfen, die Volumenänderung von Körpern bei Temperaturänderung oder die Entstehung des Gasdrucks zu deuten.
-
Kennzeichnung verschiedener Aggregatzustände in einem einfachen Teilchenmodell
Materielle Teilchenmodelle
Das oben beschriebene Teilchenmodell kann man auch als materielles Modell, also in gegenständlicher Form, realisieren. Dafür gibt es unterschiedliche Möglichkeiten, beispielsweise:
Die Teilchen sind kleine Kugeln, die dicht gepackt sind. Damit hat man ein statisches Modell vor sich.
- Die Teilchen sind durch Federn miteinander verbunden. Durch diese Federn werden die Kräfte zwischen den Teilchen verdeutlicht.
- Die Teilchen sind kleine Magnete, die sich fast reibungsfrei auf einem Luftkissentisch bewegen. Ein solches dynamisches Modell ermöglicht z.B. die Veranschaulichung der Diffusion.
Die Teilchen sind kleine Stahlkugeln, die durch eine schnell hin und her schwingende Platte in Bewegung gesetzt werden (Schüttelapparat). Ein solches dynamisches Modell ermöglicht es z.B., die Geschwindigkeitsverteilung von Teilchen zu untersuchen.
Strukturmodelle
Um sich den Aufbau von einzelnen Stoffen oder auch komplizierter Verbindungen zu verdeutlichen, verwendet man ebenfalls Teilchenmodelle (Kalottenmodelle). Phosphorsäure mit der chemischen Formel wird durch dieses Modell in seiner Zusammensetzung veranschaulicht.
Die räumliche Anordnung der Atome bzw. Moleküle wird häufig in Form von Gittern dargestellt. Man spricht dann von Gittermodellen. Atome und Moleküle sind dabei Kugeln, die Bindungen zwischen ihnen werden durch Striche gekennzeichnet.
Bei kristallinen Stoffen spricht man dann von einem Kristallgitter. Ein Beispiel für ein solches Kristallgitter ist das des Siliciumdioxids . Ein Molekül des Siliciumdioxids besteht aus einem Atom Silicium und zwei Atomen Sauerstoff, die durch polare Atombindung verbunden sind. Im Kristall bildet ein Siliciumatom mit vier Sauerstoffatomen einen Tetraeder.
Die Struktur kristalliner Festkörper kann mithilfe solcher Kristallgitter gut beschrieben werden. Die Kristallstrukturlehre ist ein Teilgebiet der Kristallografie. Unterschieden wird dabei zwischen einer Reihe von charakteristischen Gitterstrukturen. Einige davon sind in dargestellt.
Tätsächlich ist in Festkörpern und Flüssigkeiten der Abstand zwischen den Atomen nicht so, wie es in den Gittermodellen dargestellt ist. Vielmehr sind die Atome dicht gepackt. Auch das lässt sich zeichnerisch darstellen. Man spricht dann von einem Packungsmodell. Es lässt sich mithilfe kleiner Kugeln sogar darstellen und es lassen sich damit auch einige Modellexperimente durchführen.

