Enzymregulation
Enzyme dürfen im Organismus nicht permanent wirksam sein, weil ansonsten alle biochemischen Reaktionen gleichzeitig mit relativ hoher Geschwindigkeit ablaufen würden. Zum einen hängt die Enzymaktivität von der Temperatur, dem pH-Wert und der Konzentration des Substrats ab.
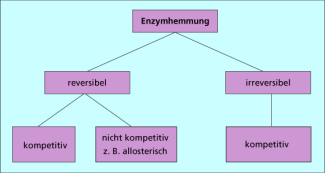
Außerdem wird die Aktivität von Enzymen nach verschiedenen Mechanismen reguliert. Durch Inhibitoren können Enzyme reversibel oder irreversibel gehemmt werden. Die reversible Enzymhemmung kann nach einem kompetitiven oder einem nicht kompetitiven Mechanismus erfolgen. Ein Sonderfall der nicht kompetitiven Hemmung ist die allosterische Regulation.
Enzyme müssen nicht permanent wirksam sein, sondern im Allgemeinen nur unter bestimmten Bedingungen biochemische Reaktionen beschleunigen. Wenn sie nicht benötigt werden, sind sie in ihrer Aktivität häufig durch Inhibitoren, die nach verschiedenen Mechanismen wirken, gehemmt.
Mechanismen der Enzymregulation
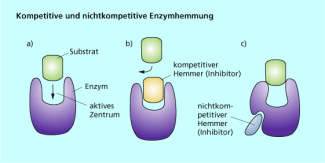
Man unterscheidet beispielsweise zwischen kompetitiven und nicht kompetitiven Inhibitoren (Bild 1). Die kompetitive Hemmung (Verdrängungshemmung) tritt auf, wenn zwei chemisch ähnliche Stoffe um das Bindungszentrum eines Enzyms konkurrieren. Nur einer der beiden Stoffe ist das Substrat. Der zweite Stoff kann zwar vom Enzym gebunden aber nicht umgesetzt werden, er wirkt als Hemmstoff. Der Hemmstoff verdrängt das eigentliche Substrat aus dem Bindungszentrum.
Seine Wirkung ist umso stärker, je größer die Konzentration im Vergleich zum eigentlichen Substrat ist. Steigt die Substratkonzentration, kann der kompetitive Inhibitor wieder verdrängt werden.
Bei der nicht kompetitiven Hemmung wird der Inhibitor an einer anderen Stelle des Enzyms gebunden. Durch diese Bindung wird die räumliche Struktur des Enzyms so verändert, dass das eigentliche Substrat nicht mehr an das aktive Zentrum passt (Bild 1). Die nicht kompetitive Hemmung ist unabhängig von der Substratkonzentration.
Sie kann aber durch sogenannte Aktivatoren wieder aufgehoben werden. Diese Sonderform der nicht kompetitiven Hemmung nennt man allosterische Hemmung.
-
Kompetitive (c) und nichtkompetitive (b) Hemmung eines Enzyms
Allosterische Regulation
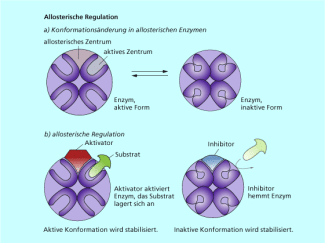
Einige Enzyme liegen im Normalfall in einer inaktiven Form vor und werden erst nach Aktivierung durch andere Moleküle katalytisch wirksam. Diese Aktivatormoleküle besetzen das allosterische Zentrum und verändern dadurch das aktive Zentrum so, dass es für die Substratmoleküle zugänglich ist. Wird das Enzym nicht mehr benötigt, dann verdrängen Inhibitoren die Aktivatoren vom allosterischen Zentrum und das Enzym wird "ausgeschaltet" (Bild 2).
-
Allosteriosche Regulation - Selektivität durch Konformation des Enzyms
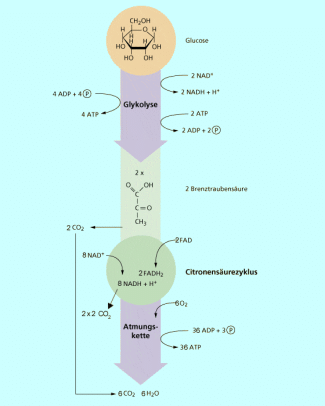
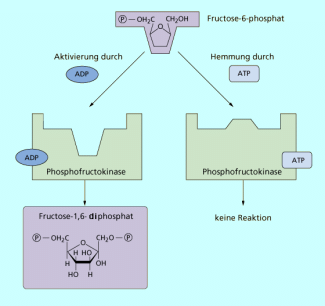
Die Prozesse der allosterischen Hemmung und Aktivierung sind umkehrbar, d. h. das Enzym kann je nach Bedarf im Stoffwechsel aus- und eingeschaltet werden. Ein Beispiel ist die Regulation der Phosphofructokinase, dem wichtigsten Enzym zur Regelung der ATP-Produktion beim Glucoseabbau (Bild 3).
Phosphofructokinase überträgt unter Beteiligung von ATP eine Phosphatgruppe auf Fructose-6-phosphat, das damit zu Fructose -1,6-diphosphat wird. Erst wenn dieses Stoffwechselprodukt vorliegt, kann Glucose zum Zweck der Energiebereitstellung in der Zelle abgebaut werden. Die Bedeutung des Enzyms liegt damit in der Regulierung der Energiemenge, die einer Zelle zur Verfügung steht.
Wenn eine Zelle viel Energie erzeugt hat, liegt folglich viel ATP vor. Wenn viel ATP vorhanden ist, ist ein weiterer Glucoseabbau nicht notwendig. Das Enzym Phosphofructokinase kann jetzt also in seiner Aktivität gehemmt werden. Dieses geschieht durch das ATP selbst. ATP ist anders gebaut als das Substrat der Phosphofructokinase und bindet an das allosterische Zentrum des Enzyms. Dadurch wird das Enzym inaktiv, bis wieder Energie in Form von ATP benötigt wird. Der Inhibitor löst sich vom allosterischen Zentrum und die Hemmung ist aufgehoben, bis wieder genug ATP vorliegt.
-
Abbau von Glucose in der Zellatmung
Phosphofructokinase ist somit eines der Schlüsselenzyme in der Zellatmung. Während der Glykolyse wandelt es Fructose-6-phosphat in Fructose-1,6-diphosphat um. Seine Aktivität wird durch hohe Citrat- und ATP-Konzentration gehemmt und durch ADP wieder aktiviert (Bild 4).
Wenn bei den Reaktionen der Zellatmung die ATP- und Citratproduktion ansteigt, wirken beide Stoffe als Inhibitoren (Hemmer) auf das Enzym Phosphofructokinase. Seine Gestalt wird so verändert, dass das Substrat Fructose-6-phosphat nicht mehr angelagert werden kann.
Sinkt die ATP- und Citratproduktion, weil das Enzym gehemmt ist, steigt die Konzentration der ADP-Moleküle. ADP bindet an das aktive Zentrum der Phosphofructokinase und verändert die Gestalt des Enzymmoleküls so, dass Fructose-6-phosphat als Substrat wieder gebunden und in Fructose-1,6-diphosphat umgewandelt werden kann.
Reversible und irreversible Enzymhemmung
Für biochemische Prozesse ist es wichtig, dass die Enzymhemmung wieder aufgehoben kann, also reversibel ist. Im Fall einer irreversiblen Hemmung ist das Enzym für den Organismus verloren und muss neu produziert werden. Die Ursache liegt darin, dass der Inhibitor so fest an das Enzym gebunden ist, dass er durch andere Stoffe nicht mehr verdrängt werden kann. Dies ist z. B. bei Vergiftungen durch Nervengase oder Schwermetalle der Fall.
Schwermetalle wie Blei oder Quecksilber können in der Enzymstruktur gebunden werden und verändern dadurch deren Passform. Die Metall-Ionen werden an SH- oder OH-Gruppen gebunden unfd blockieren dadurch das aktive Zentrum des Enzyms. Die chemische Bindung ist so stark, dass die Metall-Ionen nicht von Substratmolekülen verdrängt werden können. Das hat zur Folge, dass die Enzyme ihre Substrat- und Wirkspezifität dauerhaft verlieren.
Auch andere irreversible Hemmungen laufen meist nach einem derartigen kompetitiven Mechanismen (siehe oben) ab. Die reversible Hemmung kann sowohl kompetitiv als auch nicht kompetitiv erfolgen (Bild 5).
Die Aktivität der Enzyme hängt außerdem noch von anderen Faktoren, z. B. der Temperatur, dem pH-Wert und den Konzentrationen der Reaktionspartner ab.
-
Phosphofructokinase regelt den Glucoseabbau.
-
Einteilung der verschiedenen Mechanismen der Enzymregulation