Atommodelle
Atommodelle sind alle Vorstellungen über den Aufbau der Atome, insbesondere über die Struktur der Atomhülle. Die historisch bedeutsamsten Atommodelle sind das rutherfordsche Atommodell und das bohrsche Atommodell. Moderne Atommodelle lassen sich nur noch mathematisch beschreiben.
Entwicklung der Vorstellungen vom Aufbau des Atoms
Bereits in der Antike gab es Vorstellungen darüber, dass die Stoffe aus sehr kleinen Teilchen bestehen könnten. Diese kleinen Teilchen wurden Atome genannt (atomos bedeutet im Griechischen das Unteilbare). Ein Vertreter dieser Auffassung war der griechische Philosoph DEMOKRIT (5 Jh. v. Chr.).
Erst im 17. und 18. Jahrhundert wurden mit der Entwicklung der Wärmlehre diese Ideen wieder aufgegriffen, ohne dass die Existenz von kleinsten Teilchen nachgewiesen werden konnte. Dies gelang erst zu Beginn des 20. Jahrhunderts.
Im Laufe des 19. Jahrhunderts gab es eine ganze Reihe von experimentellen Ergebnissen, die auf die Existenz kleinster Teilchen hindeuteten. So beobachtete der Biologie ROBERT BROWN (1773-1858) im Jahr 1827 unter dem Mikroskop eine unruhige Bewegung von Blütenstaubkörnchen, die später nach ihm benannten brownsche Bewegung. Diese Bewegung konnte erst 1905 von ALBERT EINSTEIN (1879-1955) mit dem Teilchenaufbau erklärt werden.
In den siebziger und achtziger Jahren des 19. Jahrhunderts haben viele Physiker mit Katodenstrahlen experimentiert und festgestellt, dass sich diese Strahlen in elektrischen und magnetischen Feldern ablenken lassen. Der deutsche Physiker EMIL WIECHERT (1861-1928) und unabhängig davon der englische Physiker JOSEPH JOHN THOMSON (1856-1940) fanden in den neunziger Jahren des 19. Jahrhunderts heraus, dass Katodenstrahlen aus sehr kleinen Teilchen mit negativer Ladung bestehen müssten. Als Name für dieses erste Elementarteilchen wurde 1897 von dem irischen Physiker GEORGE FRANCIS FITZGERALD (1851-1901) der Begriff Elektron eingeführt, der einige Jahre vorher schon für die elektrische Elementarladung vorgeschlagen worden war. Die Katodenstrahlen erwiesen sich als schnell bewegte Elektronen, als Elektronenstrahlen.
Weitere Entdeckungen führten immer stärker zu der Frage nach den elementaren Bausteinen der Stoffe:
- 1895 fand WILHELM CONRAD RÖNTGEN (1845-1923) die nach ihm benannten Röntgenstrahlen, die offensichtlich durch Vorgänge im atomaren Bereich zustande kamen.
- 1896 hatte HENRI BECQUEREL (1852-1908) eine neue Art von Strahlung entdeckt, die dann von MARIE und PIERRE CURIE genauer untersucht wurde und die wir heute als radioaktive Strahlung kennen. Auch diese Art der Strahlung hatte offensichtlich mit atomaren Vorgängen zu tun.
Die Suche nach geeigneten Atommodellen, mit denen die experimentellen Ergebnisse erklärt werden konnten, begann.
-
Atommodell: Um den positiv geladenen Atomkern bewegen sich die negativ geladenen Elektronen.

Jens Prockat, Berlin
Die ersten Atommodelle
Im Jahr 1902 stellte WILLIAM THOMSON (LORD KELVIN) ein Atommodell vor: Das kugelförmige Atom sollte aus einer positiven elektrischen "Flüssigkeit" bestehen, in die ähnlich wie Rosinen bei einem Kuchen die negativ geladenen Elektronen eingebettet sind. Dieses „Rosinenmodell“ wurde 1903 von J. J. THOMSON weiterentwickelt: Er ging davon aus, dass sich die Elektronen um den Kern auf Ringen befinden und für jedes Element eine stabile Verteilung der Elektronen existiert. Mit diesen Modellen konnte man erklären, dass ein Atom elektrisch neutral ist. Ungeklärt blieb aber z. B. die Entstehung von Röntgenstrahlung oder von radioaktiver Strahlung.
-
Atommodell von W. Thomson (Lord Kelvin)

Das rutherfordsche Atommodell
1909/10 führte der englische Physiker ERNEST RUTHERFORD
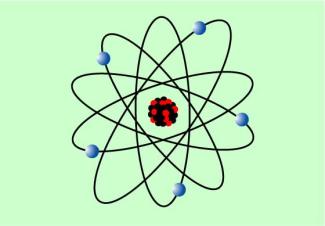
(1871-1937) mit seinen Mitarbeitern Versuche zum Durchgang von Alpha-Strahlung durch dünne Metallfolien durch. Der größte Teil der Strahlung ging hindurch und wurde z. T. abgelenkt. Bereits vorher hatte man festgestellt, dass Katodenstrahlen, also schnell bewegte Elektronen, dünne Metallfolien durchdringen können. RUTHERFORD zog daraus den Schluss, dass der größte Teil des Atoms leer ist und entwickelte ein Atommodell, das rutherfordsche Atommodell, das dem Aufbau des Planetensystems ähnelt und deshalb auch als Planetenmodell bezeichnet wird: Um einen positiv geladenen Kern, in dem die Masse des Atoms konzentriert ist, kreisen Elektronen auf elliptischen Bahnen. Die Stabilität von Atomen konnte mit diesem Modell allerdings nicht erklärt werden.
-
Rutherfordsches Atommodell
Das bohrsche Atommodell
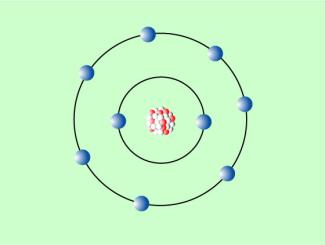
Der dänische Physiker NILS BOHR (1885-1962) brach 1913 radikal mit einigen Vorstellungen der klassischen Physik und stellte ein anderes Atommodell vor, das heute als bohrsches Atommodell bezeichnet wird: Die Elektronen bewegen sich auf bestimmten Bahnen um den Atomkern. Der jeweiligen Bahn kann eine bestimmte Energie zugeordnet werden. Wenn Energie zugeführt wird, können Elektronen auf eine kernfernere Bahn springen. Beim Zurückspringen wird diese Energie wieder frei und in Form von Strahlung, z. B. als Licht oder als Röntgenstrahlung, abgegeben. Nicht erklärt werden konnte mit dem bohrschen Atommodell die Entstehung radioaktiver Strahlung, die mit Veränderungen der Atomkerne einherging.
-
Bohrsches Atommodell
Die weitere Entwicklung
Mit der Entwicklung der Quantenphysik setzte sich die Überzeugung durch, dass man Atome prinzipiell nicht über eine Teilchenvorstellung und damit anschaulich deuten kann, sondern sich Atome nur mit komplizierten mathematischen Modellen beschreiben lassen. Für ein Elektron in der Atomhülle kann man nie genau angeben, wo es sich zu einem bestimmten Zeitpunkt befindet. Angegeben werden kann nur eine bestimmte Wahrscheinlichkeit für einen Bereich, in dem es sich aufhält.
Einen solchen Bereich, in dem die Aufenthaltswahrscheinlichkeit für ein Elektron 90 % beträgt, bezeichnet man als Orbital, das entsprechende Atommodell als Orbitalmodell.
Wichtige Veränderungen vollzogen sich auch in den Erkenntnissen vom Aufbau des Atomkerns, den man zunächst als unstrukturierten Bereich mit positiver Ladung angesehen hatte. 1932 entdeckte der englische Physiker JAMES CHADWICK (1891-1974) das Neutron. Wenige Monate darauf entwickelten unabhängig voneinander WERNER HEISENBERG (1901-1976) in Leipzig und D. D. IWANENKO (* 1904 ) in Leningrad ein neues Konzept des Kernaufbaus: Der Atomkern besteht aus Protonen und Neutronen.
Neuere Modelle sind sehr kompliziert aufgebaut und berücksichtigen die Erkenntnisse, die in den letzten Jahren in der Physik der Elementarteilchen gewonnen wurden. Einige Informationen dazu sind unter dem Stichwort Elementarteilchen zu finden.

